Щелочные металлы представляют собой группу химических элементов, которая находится в первой группе периодической таблицы. В эту группу входят следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили такое название из-за своей реакционной способности с щелочами, кислотами и водой.
Важными характеристиками щелочных металлов являются их общая химическая формула, валентность и электронная конфигурация. Общая формула щелочных металлов имеет вид M+, где M - символ элемента. Все щелочные металлы обладают валентностью равной +1, что означает, что они имеют один электрон во внешней электронной оболочке.
Щелочные металлы обладают высокой химической реакционностью, что объясняется их электронной конфигурацией. Ионизационная энергия щелочных металлов очень низкая, что делает их очень активными при взаимодействии с другими веществами.
Еще одной особенностью щелочных металлов является их мягкость и низкая температура плавления, что делает их легкообрабатываемыми и подходящими для использования в разных отраслях промышленности.
Почему щелочные металлы называют химическими элементами 1-й группы
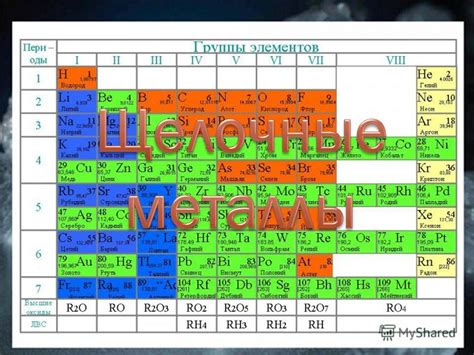
Щелочные металлы - это химические элементы, которые находятся в 1-й группе периодической таблицы. Эта группа включает литий, натрий, калий, рубидий, цезий и франций. Такое название было дано этим элементам из-за их реакционной способности и химических свойств.
Щелочные металлы очень реакционны и быстро взаимодействуют с другими элементами и соединениями. Это связано с тем, что у них внешний электронный слой имеет один электрон, которого им не хватает для заполнения энергетического уровня. Поэтому они стремятся отдать этот "лишний" электрон и таким образом достичь более стабильного состояния.
Из-за этой реакционной способности щелочные металлы образуют гидроксиды, окалины и множество других соединений. Например, они могут очень быстро реагировать с кислородом, водой, аммиаком и другими веществами.
- Литий является самым легким металлом и имеет наименьшую реакционную способность среди щелочных металлов.
- Натрий является одним из основных элементов, необходимых для поддержания здоровья человека.
- Калий широко применяется в сельском хозяйстве для удобрения почвы и поддержания здоровья растений.
- Рубидий и цезий обладают рядом интересных свойств и находят применение в различных научных исследованиях и технологиях.
- Франций является самым редким и реакционным щелочным металлом и его встречают только в следах в природе.
В целом, щелочные металлы имеют широкий спектр применения в различных отраслях науки и технологии. Их свойства и реакционная способность делают их важными элементами в химической промышленности, электрометаллургии и других областях.
Состав и свойства

Щелочные металлы входят в первую группу периодической таблицы химических элементов. Эта группа состоит из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Все эти элементы имеют общую особенность - их атомы имеют одну валентность и образуют положительные ионы.
Щелочные металлы являются самыми активными химическими элементами. Они очень реакционны и легко образуют соединения с другими элементами. Это связано с тем, что у них наружный электронный слой содержит всего один электрон, которое они готовы отдать, чтобы достичь стабильной электронной конфигурации. Поэтому щелочные металлы легко образуют ионы с положительным зарядом.
У всех щелочных металлов довольно низкая плотность и низкая температура плавления. Они имеют мягкую консистенцию и хорошую проводимость электрического тока. Кроме того, они обладают низкой теплопроводностью и низкой теплоемкостью.
Щелочные металлы очень реакционны со взаимодействующих средой, особенно с водой. При контакте с водой они выделяются водород и образуют гидроксиды. Натрий и калий используются в широком спектре промышленных и бытовых приложений, например, в производстве щелочей, пищевых добавок и взрывчатых веществ.
Электронная конфигурация
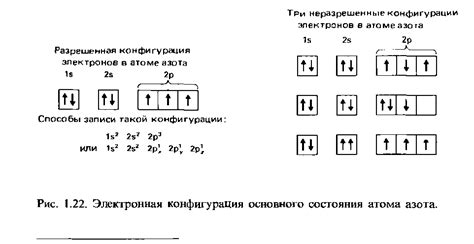
Электронная конфигурация - это распределение электронов в энергетических уровнях и подуровнях атома. Она определяет химические свойства элемента. Каждый атом стремится достичь стабильной конфигурации, в которой все энергетические уровни заполнены электронами.
Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), относятся к элементам 1-й группы периодической системы, потому что они имеют одну электрону на внешнем энергетическом уровне, обозначаемом s-подуровнем. У этих элементов энергия этого электрона является наименьшей среди всех элементов, что делает их очень реактивными.
Конфигурация электронов в щелочных металлах можно представить следующим образом: для лития электронная конфигурация будет 1s2, для натрия - 1s2 2s1, а для калия - 1s2 2s2 2p6 3s1.
Электронная конфигурация щелочных металлов влияет на их химические свойства. Стремление достичь стабильной конфигурации делает их очень реактивными и склонными к образованию положительных ионов с одним электроном внешнего энергетического уровня. Именно поэтому они легко реагируют с водой и кислородом, образуя основания и оксиды.
Щелочные металлы в природе

Щелочные металлы представляют собой группу химических элементов, которые находятся в первой группе периодической таблицы. Эти металлы легко растворяются в воде и обладают высокой реактивностью.
В природе щелочные металлы встречаются в виде соединений, таких как соли и минералы. Например, натрий присутствует в морской воде, где его содержание составляет около 2,6% по массе. Калий также обнаруживается в горных породах и почве.
Щелочные металлы играют важную роль в биологических системах. Натрий является незаменимым элементом для поддержания осмотического давления и регулирования баланса воды в организмах. Калий необходим для нормального функционирования сердца, мышц и нервной системы.
Однако, из-за высокой реактивности щелочных металлов, они не встречаются в природе в свободном состоянии. Вместо этого, они образуют связи с другими элементами, образуя соединения. Это делает их доступными для использования в таких областях, как производство стекла, селитры, ионных батарей и других продуктов промышленности.
Химические реакции

Химическая реакция - это процесс, в результате которого происходит превращение одних химических веществ в другие. В химической реакции происходит изменение состояния и свойств веществ, атомы перегруппируются, образуя новые соединения.
Химические реакции могут происходить под воздействием различных факторов, таких как тепло, свет, электричество и др. Они подразделяются на необратимые и обратимые. В необратимых реакциях образуются новые вещества и исходные вещества не могут быть восстановлены. В обратимых реакциях вещества могут превращаться друг в друга и процесс может быть обратимым.
Химические реакции могут протекать с различной скоростью. Для большинства реакций характерно проявление тепла или поглощение тепла. Также могут происходить изменения цвета, образование газов или осадков.
Важно отметить, что химические реакции подчиняются законам сохранения массы и энергии. Закон сохранения массы утверждает, что общая масса реагирующих веществ равна общей массе продуктов реакции. Закон сохранения энергии гласит, что энергия не создается и не уничтожается во время химической реакции, она только переходит из одной формы в другую.
Химические реакции играют важную роль во многих сферах нашей жизни, таких как промышленность, медицина, пищевая промышленность и др. Они позволяют создавать новые вещества с нужными свойствами, проведение анализов, продлевать сроки хранения продуктов и многое другое.
Применение в технологии

Щелочные металлы, такие как литий, натрий, калий и другие, широко используются в различных технологиях благодаря своим уникальным физическим и химическим свойствам.
Аккумуляторы: Одним из основных применений щелочных металлов в технологии является использование их в аккумуляторах. Литий-ионные аккумуляторы, содержащие литий, обладают высокой энергетической плотностью и широко применяются в портативных электронных устройствах, таких как мобильные телефоны и ноутбуки. Калиионные аккумуляторы, содержащие калий, находят применение в большом масштабе, в том числе в солнечных электростанциях и электрических автомобилях.
Металлургия: Щелочные металлы используются в металлургической промышленности для получения легированных сплавов и лития, который является важным компонентом в производстве алюминия. Калий также применяется для производства сплавов, используемых в авиастроении и ракетостроении.
Химическая промышленность: Литий и калий используются в различных химических процессах. Например, литий и его соединения используются в производстве лекарственных препаратов, стекол и синтеза органических соединений. Калий используется в производстве удобрений и стекла, а также как катализатор при производстве различных химических продуктов.
Ядерная энергетика: Литий является важным компонентом для производства термоядерной энергии. Он используется в реакторах термоядерного синтеза, где в процессе слияния ядра лития образуется гелий и освобождается большое количество энергии. Это потенциально эффективный и безопасный источник энергии, который может сыграть важную роль в будущем.
Таким образом, щелочные металлы имеют широкий спектр применения в технологии и играют важную роль в различных отраслях промышленности.
Биологическая роль

Щелочные металлы играют важную роль в биологических процессах и жизни организмов. Они присутствуют в многих биологических системах и выполняют различные функции.
Натрий является одним из основных элементов, необходимых для нормального функционирования клеток. Он участвует в регуляции осмотического давления и поддержании равновесия флюидов в организме. Также натрий играет важную роль в передаче нервных импульсов и сокращении мышц.
Калий является неотъемлемой частью функционирования нервной системы и мышц. Он участвует в передаче нервных импульсов, контролирует сердечный ритм и регулирует уровень воды в клетках. Также калий необходим для поддержания здоровья почек и работоспособности органов.
Рубидий имеет сходные функции с калием и также участвует в передаче нервных импульсов и регулировании функций мышц. Он также может оказывать влияние на уровень гормонов и холестерина в организме.
Цезий имеет специфическую роль в жизненных процессах организмов. У него есть антимикробные свойства, исследуются его возможности в борьбе с бактериями и вирусами. Также цезий может влиять на функции сердца и нервной системы.
Франций находится в следах в природе и еще малоизучен, поэтому его точная биологическая роль неизвестна. Однако предполагается, что он может влиять на работу нервной системы и клеток организма.
На основе этих фактов можно заключить, что щелочные металлы играют важную роль в биологии организмов. Они необходимы для нормального функционирования клеток, передачи нервных импульсов и поддержания баланса флюидов. Также они могут оказывать влияние на функции сердца и нервной системы. Исследования в этой области позволят лучше понять влияние щелочных металлов на жизнь организмов и развить новые подходы в медицинской практике.
Опасность и меры предосторожности

Щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) представляют опасность при взаимодействии с водой и воздухом. Их реакция с водой может быть весьма интенсивной, что приводит к выделению большого количества водорода, что влечет за собой возможность возникновения пожара или даже взрыва.
При контакте с воздухом, щелочные металлы быстро окисляются, что может привести к возгоранию и образованию едкого газа оксида. Для предотвращения подобных ситуаций, необходимо соблюдать определенные меры предосторожности.
Перед работой с щелочными металлами необходимо надеть специальные защитные перчатки, халат и очки, чтобы избежать контакта с кожей и глазами. Работать следует в хорошо проветриваемой помещении или под вытяжкой, чтобы уменьшить возможность скопления газов. Во время работы с щелочными металлами не рекомендуется употреблять пищу или пить воду, чтобы предотвратить случайное попадание вещества в организм.
По окончании работы необходимо тщательно промыть все инструменты и рабочую поверхность, чтобы полностью удалить остатки щелочных металлов. Отходы следует собирать в специально предназначенные контейнеры для последующей утилизации.
В случае аварийной ситуации или контакта с щелочными металлами необходимо немедленно обратиться за медицинской помощью. Врачи и специалисты будут знать, как обработать поврежденные участки тела и предоставить необходимую помощь.
Используя предосторожности и соблюдая меры безопасности, можно минимизировать риск возникновения опасных ситуаций при работе с щелочными металлами.
Вопрос-ответ

Чем характеризуются щелочные металлы и почему они называются элементами 1-й группы?
Щелочные металлы - это химические элементы, которые принадлежат к 1-й группе периодической таблицы. Они характеризуются низкой электроотрицательностью, что означает, что они обладают способностью легко отдавать электроны при химических реакциях. Они также имеют низкую температуру плавления и кипения, а также низкую плотность. Эти элементы образуют щелочные гидроксиды, которые обладают щелочными свойствами и обычно растворяются в воде.
Какие элементы относятся к щелочным металлам и почему они объединены в 1-ю группу?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они объединены в 1-ю группу, потому что у них во внешней электронной оболочке находится только один электрон, что делает их химически очень активными. Это значит, что они стремятся отдать этот электрон и образовать положительный ион с однократно положительным зарядом. Эти элементы имеют схожие свойства и образуют щелочные оксиды и гидроксиды при реакции с кислородом или водой соответственно.
Какие особенности характерны для щелочных металлов, объединенных в 1-ю группу?
Щелочные металлы, входящие в 1-ю группу, имеют несколько общих особенностей. Они очень реактивны и горят на воздухе, им свойственно образование блестящей поверхности из-за окисления их поверхности. Они также имеют низкую плотность, что делает их легкими для своего размера. Щелочные металлы легко растворяются в воде и обладают щелочными свойствами - они способны образовывать гидроксиды, которые обладают щелочной реакцией с водой. По этим причинам они были объединены в 1-ю группу периодической таблицы.
