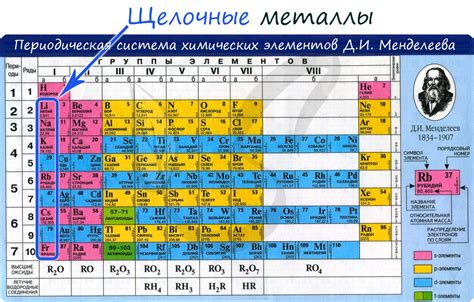
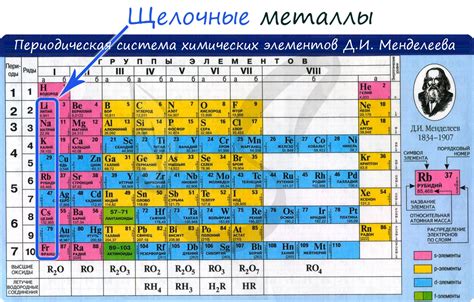
Щелочные металлы, такие как литий, натрий, калий и др. являются сильными восстановителями из-за своей низкой ионизационной энергии. Ионизационная энергия определяет энергию, необходимую для удаления одного электрона от атома щелочного металла. У щелочных металлов ионизационная энергия является наименьшей среди всех элементов в периодической системе.
Следует отметить, что низкая ионизационная энергия в свою очередь обусловлена большим радиусом и слабой связью между ядром и электронами в атоме щелочного металла. Благодаря этому, электроны в щелочных металлах относительно легко отрываются, что дает возможность им эффективно участвовать в реакциях восстановления.
Щелочные металлы проявляют свои восстановительные свойства прежде всего при взаимодействии с окислителями. В результате процесса восстановления, щелочные металлы сами окисляются, переходя из обычного атомного состояния в ионное состояние, образуя положительно заряженные ионы. Их способность к восстановлению делает щелочные металлы важными компонентами общего химического процесса и играет ключевую роль во многих технологических и промышленных процессах.
Что такое щелочные металлы?
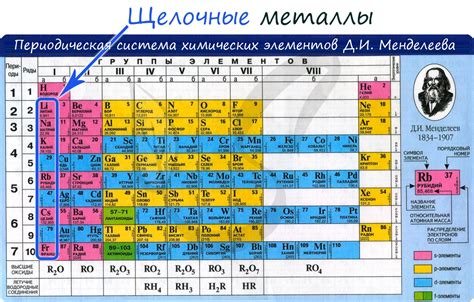
Щелочные металлы – группа элементов таблицы Mendeleev, к которым относятся литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой реактивностью и обладают большими химическими и физическими свойствами.
Щелочные металлы имеют малую плотность и низкую температуру плавления. Они являются мягкими и легкими, могут быть нарезаны ножом. Отличительной особенностью щелочных металлов является их способность сильно реагировать с водой, при этом выделяя большое количество водорода.
Щелочные металлы обладают высокой электроотрицательностью, что делает их сильными восстановителями. Они легко отдают свои электроны, образуя положительно заряженные ионы. В реакциях с другими элементами, щелочные металлы активно взаимодействуют, образуя стабильные соединения.
Щелочные металлы имеют ряд практических применений. Например, калий используется в сельском хозяйстве в виде минеральных удобрений. Натрий широко применяется в производстве стекла, а также в металлургии для очистки металлов. Литий используется в производстве легких аккумуляторов и лекарственных препаратов.
Свойства щелочных металлов

Щелочные металлы - это группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом уникальных свойств, которые делают их важными в различных областях науки и технологий.
1. Активность: Щелочные металлы являются самыми активными металлами в периодической системе. Они легко реагируют с кислородом и водой, выделяя при этом большое количество тепла. Это свойство делает их отличными зажигалками.
2. Низкая плотность: Щелочные металлы имеют низкую плотность, что делает их легкими и хорошо плавающими на воде. Это свойство позволяет использовать натрий и калий в пожаротушении, так как они могут реагировать с водой и выделять водород, который эффективно затушит огонь.
3. Высокая реактивность: Щелочные металлы очень реактивны и легко образуют ионы положительного заряда. Это позволяет им быть хорошими восстановителями в химических реакциях, где они передают электроны другим веществам. Благодаря этому свойству щелочные металлы широко используются в процессах восстановления и синтеза в органической и неорганической химии.
4. Образование солей: Щелочные металлы образуют соли с различными кислотами. Это свойство делает их важными реагентами в лабораториях и промышленности для производства различных соединений, таких как карбонаты, галогениды и нитраты. Кроме того, соли щелочных металлов широко применяются в пищевой, фармацевтической и косметической промышленности.
5. Электропроводность: Щелочные металлы хорошие проводники электричества. Это свойство делает их полезными для производства батарей и аккумуляторов. Кроме того, ионы щелочных металлов имеют важное значение для функционирования клеток в живых организмах.
В целом, свойства щелочных металлов делают их важными элементами для многих отраслей науки и промышленности, от химии и электротехники до фармацевтики и пищевой промышленности.
Как ведут себя щелочные металлы в химических реакциях?

Щелочные металлы – это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются сильными восстановителями и обладают свойством активно взаимодействовать с другими веществами.
Щелочные металлы обладают высокой реакционной способностью и легко вступают в химические реакции. Они отдают свой электрон и образуют положительный ион, которому свойственна высокая химическая активность. Взаимодействие щелочных металлов с кислородом приводит к образованию оксидов.
Кроме того, щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород. Например, натрий реагирует с водой по экзотермической реакции:
- 2Na + 2H2O → 2NaOH + H2
В результате данной реакции образуется сильное основание – гидроксид натрия. При этом выделяется водород, который можно обнаружить с помощью специального испытания с палочкой, горящей у пламени.
В химических реакциях щелочные металлы выступают в качестве сильных восстановителей – они способны отдавать свои электроны и снижать окислительные свойства других веществ. Эта особенность щелочных металлов достаточно широко используется в индустрии и научных исследованиях.
Процессы окисления и восстановления щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, являются сильными восстановителями, то есть способны передавать электроны другим веществам. Это свойство связано с их электронной конфигурацией и высокой реакционной способностью.
В процессе окисления щелочные металлы теряют электроны и образуют положительно заряженные ионы. Например, литий может окисляться до иона Li+ при взаимодействии с кислородом. Это происходит из-за высокой энергии иона лития, что позволяет ему отдать свои электроны другим веществам и проявлять свойство восстановителя.
Восстановительные свойства щелочных металлов находят широкое применение в различных отраслях, включая химическую, электрохимическую и металлургическую промышленность. Они используются в процессе получения металлов, в гальванических элементах и акумуляторных батареях, а также в процессах синтеза органических соединений и производства средств бытовой химии.
Важно отметить, что щелочные металлы обладают большой химической активностью и реакционной способностью, что требует соблюдения мер предосторожности при работе с ними. Открытые щелочные металлы быстро реагируют с влажным воздухом и водой, образуя гидроксиды и обильное выделение водорода.
Почему щелочные металлы хорошие восстановители?

Щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) обладают свойствами хороших восстановителей. Восстановитель - это вещество, способное передавать электроны другим веществам в химических реакциях.
В основе способности щелочных металлов к восстановлению лежит их электронная конфигурация. У щелочных металлов внешний электронный уровень состоит из одной электронной оболочки и содержит один электрон. Данная электронная конфигурация делает щелочные металлы очень реактивными и склонными к восстановительным реакциям.
Электроны во внешней оболочке щелочных металлов легко отдаются другим веществам, что позволяет этим металлам вступать в реакции окисления-восстановления. При этом щелочные металлы сами окисляются, теряют один или несколько электронов и превращаются в ионы положительного заряда.
Такие реакции восстановления с участием щелочных металлов широко применяются в разных областях химии и промышленности. Например, калий используется во многих реактивных процессах, таких как производство удобрений, стекла, щелочных металлов и других химических соединений. Натрий применяется в производстве щелочей, мыла, стекла и многих других продуктов.
Важно отметить, что из-за высокой реакционной способности щелочные металлы являются пожароопасными и опасными веществами. При контакте с воздухом или водой они могут привести к негативным последствиям, таким как взрывы или пламя. Поэтому при работе с щелочными металлами необходимо соблюдать осторожность и принимать соответствующие меры безопасности.
Электрохимические свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., относятся к одной из самых активных групп элементов в периодической системе. Они обладают высокой степенью реакционности и, благодаря своим свойствам, широко применяются в различных сферах науки и промышленности.
Одним из ключевых электрохимических свойств щелочных металлов является их способность выступать в роли сильных восстановителей. Это связано с их низкой ионизационной энергией и способностью легко отдавать электроны. Щелочные металлы имеют один свободный электрон в внешней оболочке, что делает их очень реакционноспособными и легко окисляемыми.
В химических реакциях щелочные металлы могут активно участвовать в обмене электронами с другими веществами. Они способны отдавать электроны, образуя положительно заряженные ионы, которые могут взаимодействовать с отрицательно заряженными ионами или нейтральными молекулами. Это позволяет использовать щелочные металлы в различных электрохимических процессах, таких как электролиз, аккумуляция энергии и производство металлов.
Кроме того, электрохимические свойства щелочных металлов позволяют им выступать в качестве катализаторов химических реакций. Они могут активировать молекулы веществ, способствуя их превращению и повышению скорости химической реакции. Это свойство щелочных металлов находит применение в синтезе органических соединений, производстве лекарств и катализе промышленных процессов.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам и химической активности.
Литий, благодаря своей низкой плотности и химической стабильности, широко используется в производстве аккумуляторов. Аккумуляторы на основе лития обладают высокой удельной емкостью и обеспечивают долгий срок службы. Кроме того, литий используется в производстве керамики и стекла, а также в фармацевтической промышленности.
Натрий, благодаря своей высокой электроотрицательности и способности образовывать соединения с широким спектром веществ, находит применение в различных отраслях промышленности. Натрий используется в производстве стекла, щелочей, мыла, шампуней и моющих средств. Он также применяется в пищевой промышленности в качестве консерванта и добавки для придания вкуса.
Калий является важным элементом в сельском хозяйстве. Он используется в производстве удобрений для повышения плодородия почвы и увеличения урожайности. Кроме того, калий применяется в производстве стекла, мыла, щелочей и в некоторых лекарственных препаратах. Он также используется в жидком состоянии в ракетных двигателях.
В целом, щелочные металлы играют важную роль в различных сферах промышленности и находят широкое применение благодаря своей химической активности и уникальным свойствам.
Роль щелочных металлов в различных отраслях производства

Щелочные металлы, такие как литий, натрий и калий, играют важную роль во многих отраслях производства благодаря своим уникальным свойствам.
В области электроники, щелочные металлы используются для создания литий-ионных аккумуляторов, которые являются источником питания для мобильных устройств, ноутбуков и электромобилей. Литиевые батареи обладают высокой энергоемкостью и длительным сроком службы, что делает их незаменимыми в современных технологиях.
Органические соединения щелочных металлов активно применяются в химической промышленности для производства пластмасс, полимерных материалов, красителей и лекарственных препаратов. Натрий и калий являются ключевыми компонентами многих химических реакций и катализаторов, что позволяет эффективно и экономично производить широкий спектр продукции.
Щелочные металлы также широко используются в производстве стекла и керамики. Они участвуют в качестве расплавителей, обеспечивая плавление и формирование материала. Калийные и натриевые соединения придают стеклу и керамике определенные свойства, такие как прозрачность, прочность или способность поглощать свет.
В металлургии, щелочные металлы используются для очистки и регулирования физико-химических свойств металлов. Например, натрий используется при производстве алюминия, чтобы удалить примеси и улучшить его качество. Щелочные металлы также применяются для производства сплавов, которые используются в авиационной и автомобильной промышленности.
Кроме того, щелочные металлы находят применение в пищевой и фармацевтической промышленности. Например, натрий используется в производстве соли и соды, которые широко применяются в пищевой промышленности для придания вкуса и консервации продуктов. Калий является важным минералом для человека и используется в производстве лекарственных добавок и диетических продуктов.
Таким образом, щелочные металлы играют важную роль в различных отраслях производства благодаря своим уникальным свойствам и химическим возможностям. Их использование способствует развитию современных технологий, обеспечивает эффективность и снижение затрат в производстве, а также позволяет создавать разнообразную и качественную продукцию в различных отраслях экономики.
Опасность и меры предосторожности при работе с щелочными металлами
Щелочные металлы, такие как литий, натрий и калий, являются сильными восстановителями и могут представлять опасность при работе с ними. Взаимодействие с водой или кислородом может привести к возгоранию или взрыву. Поэтому необходимо соблюдать определенные меры предосторожности при работе с этими металлами.
Наиболее важным правилом при работе с щелочными металлами является ношение соответствующей защитной экипировки. Рекомендуется использовать хлорированные резиновые перчатки, защитные очки и халат. Это поможет предотвратить запахи, коррозию и образование ожогов на коже.
Работа с щелочными металлами должна проводиться только в хорошо проветриваемых помещениях или под вытяжным шкафом. Это необходимо для предотвращения накопления взрывоопасных паров. Также следует избегать того, чтобы эти металлы контактировали с водой или кислородом, что может привести к негативным последствиям.
Для более безопасной работы с щелочными металлами рекомендуется использовать специальные контейнеры или реакционные сосуды, которые могут выдерживать коррозию и препятствовать взаимодействию металлов с воздухом или водой. Также необходимо хранить эти металлы в специальных контейнерах, отдельно от других химических веществ.
В случае возникновения пожара при работе с щелочными металлами необходимо немедленно применить средства пожаротушения, подходящие для гашения огня класса D. Рекомендуется использовать специальные песочные или гранулированные средства для потушения пожара с щелочными металлами.
Соблюдение этих мер предосторожности позволит минимизировать риск несчастных случаев и обеспечить безопасную работу с щелочными металлами.
Требования безопасности при обращении с щелочными металлами

Щелочные металлы, такие как литий, натрий и калий, являются сильными восстановителями и могут быть опасны при неправильном обращении. При работе с этими веществами необходимо соблюдать определенные требования безопасности, чтобы предотвратить возможные аварийные ситуации.
Первое, что необходимо помнить, – это неприемлемость контакта щелочных металлов с водой. При попадании металла в воду происходит интенсивное выделение водорода, что может привести к взрыву. Также следует избегать контакта металлов с кислородом, поскольку они могут воспламеняться при взаимодействии с кислородом в воздухе.
Для безопасного хранения и перевозки щелочных металлов рекомендуется использовать контейнеры из неметаллических материалов, таких как пластик или стекло. Эти материалы мало реактивны по отношению к щелочным металлам и предотвращают их взаимодействие с окружающей средой.
При проведении экспериментов с щелочными металлами необходимо применять перчатки и защитные очки, чтобы избежать контакта с кожей и глазами. В случае, если металл попадает на кожу, необходимо тщательно промыть место поражения водой и немедленно обратиться к медицинской помощи.
В заключение, безопасное обращение с щелочными металлами требует соблюдения определенных мер предосторожности. Необходимо избегать контакта с водой и кислородом, использовать специальные контейнеры для хранения и перевозки, а также применять защитные средства при проведении экспериментов. Соблюдение этих требований поможет предотвратить возможные аварийные ситуации и обеспечить безопасность обращения с щелочными металлами.
Вопрос-ответ

Почему щелочные металлы являются сильными восстановителями?
Щелочные металлы, такие как литий, натрий, калий и др., являются сильными восстановителями из-за своей способности образовывать ионное соединение с отрицательно заряженным атомом или группой атомов. Эти металлы имеют один электрон во внешней оболочке, что делает их очень реактивными и способными отдавать электроны при взаимодействии с другими веществами. Поэтому они эффективно восстанавливают другие вещества, увеличивая уровень электронов в их структуре.
Какие свойства делают щелочные металлы сильными восстановителями?
Одним из главных свойств, делающих щелочные металлы сильными восстановителями, является их низкая ионизационная энергия. Это означает, что энергия, необходимая для удаления электрона из внешней оболочки атома щелочного металла, очень мала. Ионизационная энергия у щелочных металлов столь низкая из-за их большого радиуса и слабой силы притяжения между ядром и внешними электронами. Благодаря этому, щелочные металлы легко отдают электроны и способны восстанавливать окислители во многих химических реакциях.
Что такое окислительно-восстановительные реакции и как щелочные металлы воздействуют на них?
Окислительно-восстановительные реакции - это реакции, в которых происходит передача электронов между веществами. В окислительно-восстановительных реакциях происходит окисление одного вещества и одновременное восстановление другого. Щелочные металлы играют роль восстановителей в таких реакциях, так как они способны легко отдавать свой внешний электрон и восстанавливать окислители. Их низкая ионизационная энергия и способность формировать ионное соединение делают их сильными восстановителями, способными эффективно восстанавливать другие вещества в реакциях.