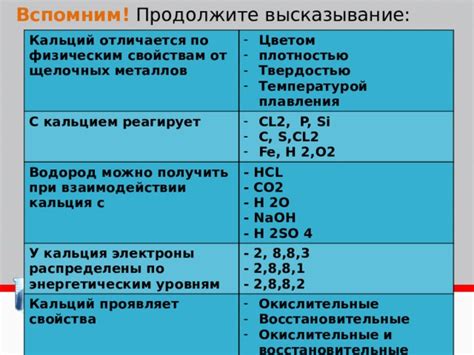
Водород - химический элемент, первый по порядку в периодической таблице. Его атом содержит всего один протон и один электрон, что делает его самым простым элементом во всей таблице. При комнатной температуре и давлении водород существует в виде двухатомных молекул H2. Несмотря на свою простоту, водород отличается от щелочных металлов и является неметаллом.
Изначально водород был расположен среди щелочных металлов в периодической таблице, так как у него один электрон в своей валентной оболочке, что характерно для металлов. Однако с течением времени было обнаружено, что водород проявляет свойства неметаллов. Он образует соединения с такими элементами, как кислород, азот, сера, образуя кислоты и огнестойкие оксиды.
Еще одной особенностью водорода как неметалла является его электроотрицательность. Водород имеет электроотрицательность меньше, чем у типичных металлов, но больше, чем у большинства представителей группы неметаллов. Это делает его химически активным и способным образовывать связи с другими элементами, в том числе неметаллами, обладающими большей электроотрицательностью.
Водород: химический элемент и его особенности

Водород (H) — самый легкий химический элемент, который входит в составо молекулы воды (H2O). Водород обладает уникальными свойствами, которые делают его одновременно похожим и отличным от щелочных металлов.
Во-первых, водород имеет сходство с щелочными металлами, так как может образовывать положительный ион H+, аналогичный ионам металлов. Однако в отличие от щелочных металлов, водород не образует катионы, а является свободным газом.
Во-вторых, водород обладает низкой плотностью и водородные молекулы легче воздуха, поэтому водород используется как заполнитель воздушных шаров и воздушных судов. Хотя у щелочных металлов также низкая плотность, они имеют металлическую структуру и образуют твердые кристаллы.
В-третьих, водород может образовывать соединения со многими элементами, включая себя же, что делает его универсальным веществом. Щелочные металлы, такие как натрий и калий, образуют соединения только с кислородом и другими элементами, не образуя водорода.
В-четвертых, химические свойства водорода обусловлены его электроотрицательностью, которая велика по сравнению с щелочными металлами. Водород способен легко отдавать или принимать электроны, что обуславливает его реакционную способность.
В заключение, водород, несмотря на сходство с щелочными металлами, является неметаллом из-за своих особенностей, таких как газообразное состояние, низкая плотность, способность образовывать соединения с различными элементами и высокая электроотрицательность.
Щелочные металлы и их свойства

Щелочные металлы - это группа химических элементов, относящихся к первой группе периодической таблицы. В эту группу входят такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы являются самыми реактивными из всех элементов.
Одной из основных особенностей щелочных металлов является их низкая плотность. Например, литий - самый легкий из всех металлов и имеет плотность всего 0,53 г/см³. Также щелочные металлы имеют низкую температуру плавления и кипения.
Важной характеристикой щелочных металлов является их высокая реактивность с водой. При контакте с водой они образуют щелочные растворы, выделяясь водород. Это происходит из-за того, что щелочные металлы очень легко отдают свой электрон, что позволяет им образовывать ионы с положительным зарядом.
Щелочные металлы также очень реактивны с кислородом, образуя оксиды. Например, литий при контакте с воздухом начинает активно окисляться и образует оксид лития (Li₂O).
Кроме того, щелочные металлы обладают хорошей проводимостью электричества и тепла. Это делает их важными компонентами в различных электрических и тепловых устройствах. Например, литий используется в аккумуляторах, а калий - в удобрениях.
Таким образом, щелочные металлы отличаются своими уникальными химическими свойствами, которые делают их востребованными в различных отраслях промышленности и науки.
Почему водород отличается от щелочных металлов?
1. Атомная структура: Водород и щелочные металлы имеют различную атомную структуру. Водород в своей основной форме состоит из одного протона и одного электрона, в то время как щелочные металлы имеют от 1 до 7 электронов в своей внешней оболочке.
2. Химические свойства: Водород обладает рядом химических свойств, которые отличают его от щелочных металлов. Например, водород может образовывать соединения с другими элементами, такими как кислород и углерод, образуя воду и углеводороды. Щелочные металлы, в свою очередь, склонны образовывать ионы положительного заряда и реагировать с водой.
3. Физические свойства: Водород обладает рядом физических свойств, которые делают его отличным от щелочных металлов. Например, водород является газообразным при нормальных условиях температуры и давления, в то время как щелочные металлы, такие как натрий и калий, являются твердыми при комнатной температуре.
4. История открытия: Водород был открыт и исследован раньше, чем щелочные металлы. Первое упоминание о водороде можно найти уже в XIII веке, в то время как открытие первого щелочного металла - лития, произошло только в XIX веке.
5. Частота встречаемости: Водород встречается в большом количестве в природе, в основном в составе воды. Щелочные металлы, в свою очередь, встречаются в природе в ограниченном количестве и в основном находятся в минералах.
Водород как неметалл: причины и объяснения

Водород является химическим элементом из первой группы периодической таблицы и имеет атомный номер 1. Несмотря на свою позицию и сходство с щелочными металлами, водород классифицируется как неметалл. Это обусловлено несколькими причинами.
Во-первых, водород обладает малым радиусом атома, что делает его более похожим на неметаллы, чем на металлы. Водородный атом имеет одну электронную оболочку, которая может содержать только два электрона. Это приводит к тому, что водороду необходимо получить или отдать один электрон для образования стабильной конфигурации.
Во-вторых, химические свойства водорода также указывают на его неметаллическую природу. Водород образует соединения, которые в основном являются ковалентными, где электроны имеют совместное использование между атомами. Это отличается от химических свойств металлов, которые образуют металлические связи, характеризующиеся перемещением электронов.
Кроме того, водородный ион (H-) является анионом, что также свидетельствует о его неметаллической природе. В заряженном состоянии водород имеет свойства аниона, проявляющего кислотные свойства.
В целом, хотя водород обладает некоторыми сходствами с щелочными металлами, его химические свойства и его позиция в периодической таблице определяют его как неметалл. Изучение особенностей водорода важно для понимания его роли в различных химических реакциях и применений.
Вопрос-ответ

Почему водород, несмотря на сходство с щелочными металлами, является неметаллом?
Водород является неметаллом из-за своих особых свойств и положения в периодической таблице элементов. Хотя водород имеет одну электрон в валентной оболочке, как щелочные металлы, он также обладает особенностями, которые делают его эксклюзивным и классифицируют его как неметалл.
В чем отличия водорода от щелочных металлов?
Первое отличие заключается в атомной структуре. Щелочные металлы находятся в периоде 2 периодической таблицы, в то время как водород находится в первом периоде. Водород имеет только один электрон в валентной оболочке, что делает его более похожим на газы группы инертных газов. Еще одно отличие заключается в свойствах водорода в сочетании с другими элементами – он может иметь ионообразные, ковалентные и металлические свойства, в то время как щелочные металлы, в основном, образуют ионные соединения.
Какая химическая активность у водорода?
Водород обладает высокой химической активностью и может образовывать соединения с различными элементами. Возможными реакциями водорода являются его соединение с кислородом, образование воды, или с хлором, образование соляной кислоты. Кроме того, водород может образовывать соединения с металлами или образовывать аммиак, который используется в сельском хозяйстве.
