Щелочноземельные металлы — это группа химических элементов, расположенных во второй группе периодической системы Д.И. Менделеева. Они включают бериллий(Be), магний(Mg), кальций(Ca), стронций(Sr), барий(Ba) и радий(Ra). Название "щелочноземельные" было дано этой группе элементов в связи с их подобием к щелочным металлам, которые находятся в первой группе.
Основополагающая характеристика щелочноземельных металлов — их активность. Они очень реакционны и легко образуют ионные соединения с другими элементами. Это свойство объясняется электронной структурой атомов щелочноземельных металлов. Внешний электронный слой всех этих металлов состоит из двух электронов, поэтому для образования ионов щелочноземельные металлы могут потерять эти два электрона и стать двухзарядными катионами.
Как и щелочные металлы, щелочноземельные металлы реагируют с водой, образуя щелочные растворы, что подтверждает их сходство с первой группой элементов периодической системы. Однако, в отличие от щелочных металлов, щелочноземельные металлы менее реакционны. Они менее активно взаимодействуют с водой и медленнее растворяются, образуя гидроксиды, содержащие катионы со знаком +2.
Откуда происходит название "щелочноземельные металлы"?

Щелочноземельные металлы – это группа химических элементов, которые относятся к II группе периодической таблицы. Название "щелочноземельные" происходит от латинского слова "alkaline earth", что означает "щелочь Земли".
Название связано с тем, что щелочноземельные металлы образуют щелочные оксиды и гидроксиды, а также образуют оксиды и гидроксиды, входящие в состав земель. Щелочноземельные металлы имеют сходные химические свойства, поэтому они объединены в одну группу.
Щелочноземельные металлы включают в себя магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они химически активны и реактивны, но менее активны, чем щелочные металлы из I группы периодической таблицы.
- Магний является легким, прочным металлическим элементом, широко применяемым в промышленности.
- Кальций имеет важное значение для живых организмов, он является необходимым для формирования костей и зубов.
- Стронций и его соединения применяются в производстве пиротехнических смесей.
- Барий используется в медицине для рентгеновской диагностики, а также в производстве стекла и фармацевтических препаратов.
- Радий является радиоактивным элементом и использовался в прошлом в медицине и для производства источников излучения.
Таким образом, название "щелочноземельные металлы" отражает химические свойства и применение элементов этой группы, связанные с образованием щелочных оксидов и гидроксидов, а также их включением в состав земель.
Истоки названия "щелочноземельные металлы"

Название "щелочноземельные металлы" происходит от свойств и особенностей химической активности этих элементов. Они относятся к 1-й и 2-й группам периодической системы и имеют достаточно сходные свойства.
Первый элемент этой группы - бериллий, был обнаружен в середине XVIII века французским химиком Лавуазье. Его название произошло от греческого слова "beryllos", что означает "аквамарин". Бериллий был получен в виде оксида, из которого затем был получен металлический бериллий.
Другие элементы этой группы, такие как магний, кальций, стронций и барий, были открыты в XIX веке. Названия этих элементов также связаны с их свойствами и происхождением.
Например, название "магний" происходит от греческого слова "magnesia", что означает регион в Малой Азии, где были найдены первые минералы, содержащие магний. Кроме этого, магний является одним из основных компонентов магния, широко распространенного в природе.
Аналогично, название "кальций" происходит от латинского слова "calx", что означает "известь". Это связано с тем, что известь - одно из наиболее распространенных соединений кальция в природе. Также известны другие полезные свойства кальция, такие как его роль в поддержании костной массы.
Таким образом, название "щелочноземельные металлы" основано на химических свойствах и происхождении этих элементов, и оно подразумевает их общие характеристики и сходство.
Особенности химических свойств щелочноземельных металлов

Щелочноземельные металлы – это группа химических элементов, которые находятся во второй группе периодической системы. К ним относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Одним из основных свойств щелочноземельных металлов является их высокая реактивность. Они активно взаимодействуют с кислородом, водой и многими другими веществами. Как правило, при реакциях с водой щелочноземельные металлы образуют гидроксиды, основания.
Щелочноземельные металлы обладают также высокой электроотрицательностью. Они легко отдают свои электроны, что делает их прекрасными катионами. Из-за этого свойства щелочноземельные металлы часто вступают в химические реакции с анионами, образуя стабильные соли.
Еще одной особенностью химических свойств щелочноземельных металлов является их способность образовывать сплавы с другими металлами. Щелочноземельные металлы могут образовывать сплавы с алюминием, магнием и другими элементами. Эти сплавы обладают высокой прочностью и устойчивостью к окислению.
Таким образом, щелочноземельные металлы обладают рядом уникальных химических свойств, которые определяют их широкое использование в различных отраслях, включая производство сплавов, алюминия, удобрений и других химических соединений.
Распространенность щелочноземельных металлов в природе
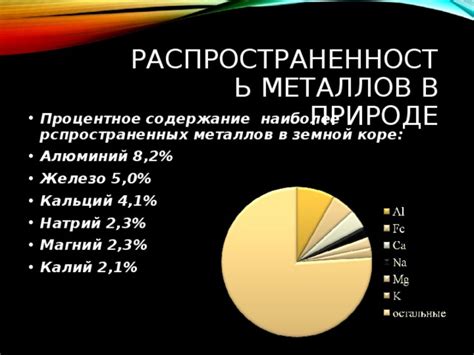
Щелочноземельные металлы - это группа химических элементов, которые распространены в природе в значительных количествах. Они входят в состав множества минералов и горных пород, и поэтому их обнаружение в природе и их добыча не представляют особых трудностей. Эти металлы имеют важное значение не только для непосредственных применений в промышленности, но и для научных исследований.
Сам по себе кальций, принадлежащий к категории щелочноземельных металлов и являющийся одним из самых распространенных элементов на Земле, составляет обширную часть земной коры. Почти вся кислотность земного шара и утепление его атмосферы, связанные с этой кислотностью, связаны с наличием в коре кальция. Как показывают исследования, кальций составляет примерно 3,64% по массе Земной коры.
Магний, второй по распространенности щелочноземельный металл, тоже находится в значительных количествах в земной коре. Он превосходит по распространенности своего соседа по периодической системе – натрия, приходящегося на третью ступень алкаловной подгруппы.
Стронций, барий и рафтоний, другие элементы группы щелочноземельных металлов, также обладают умеренной распространенностью в натуральных условиях. Они находятся в составе различных минералов и горных пород, что позволяет добывать их в определенных количествах и использовать в различных областях промышленности и науки.
Применение щелочноземельных металлов в различных отраслях

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, широко применяются в различных отраслях, благодаря своим уникальным физическим и химическим свойствам.
Магний, например, является легким металлом с высокой прочностью и низкой плотностью. Это делает его идеальным материалом для авиационной и автомобильной промышленности. Магниевые сплавы применяются для изготовления легких и прочных летательных аппаратов, автомобильных деталей и компонентов велосипедов.
Кальций является одним из основных компонентов цемента и бетона. Он также используется в металлургической промышленности для очистки железа от примесей и в производстве стали. Кальций-карбид, получаемый из кальция, используется в производстве ацетилена, который является важным промышленным сырьем для изготовления пластмасс, синтетических волокон и других химических соединений.
Стронций и барий имеют свойства, позволяющие им использоваться во многих областях. Например, стронций используется в производстве огней и сигналов, так как его соединения обладают яркими светящимися свойствами. Барий используется в медицине, особенно в рентгенологии, для создания контрастных веществ, которые позволяют получать более четкие изображения внутренних органов.
Бериллий, хотя и редкий по своему распространению, имеет множество применений в различных отраслях. Благодаря своей легкости, прочности и теплопроводности, бериллиевые сплавы используются в аэрокосмической промышленности для создания надежных конструкций и компонентов, таких как космические корабли и спутники. Бериллий также используется в производстве электронной техники, включая компьютеры и мобильные устройства, благодаря своей способности проводить тепло и электричество.
В целом, щелочноземельные металлы играют важную роль в различных отраслях и обеспечивают надежность, прочность и функциональность в различных приложениях.
Важность щелочноземельных металлов для живых организмов
Щелочноземельные металлы – группа химических элементов, оказывающая значительное влияние на живые организмы. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Магний является одним из самых важных щелочноземельных металлов для живых организмов. Он играет роль катализатора во многих реакциях, включая синтез ДНК и РНК. Также магний необходим для правильной работы нервной системы и поддержания здоровья костей.
Кальций является ключевым элементом для строительства и поддержания здоровых костей и зубов. Он участвует в многих процессах в организме, включая свертывание крови, нормализацию сердечного ритма и функционирование мышц и нервной системы.
Стронций и барий также важны для живых организмов, особенно для здоровья костей. Они участвуют в процессе роста и развития костной ткани, а также помогают поддерживать костную плотность и прочность.
Бериллий и радий являются менее распространенными щелочноземельными металлами, но все равно играют важную роль в живых организмах. Бериллий используется во многих промышленных процессах и может быть токсичным, поэтому необходимо соблюдать осторожность при контакте с ним. А радий, являясь радиоактивным элементом, может быть опасным для здоровья в больших количествах.
В целом, щелочноземельные металлы играют важную роль в жизнедеятельности организмов. Они необходимы для многих биохимических процессов и поддержания здоровья костей, нервной системы и мышц. Однако, как и с любыми другими химическими элементами, необходимо соблюдать осторожность и контролировать их уровень в организме.
Взаимодействие щелочноземельных металлов с другими элементами
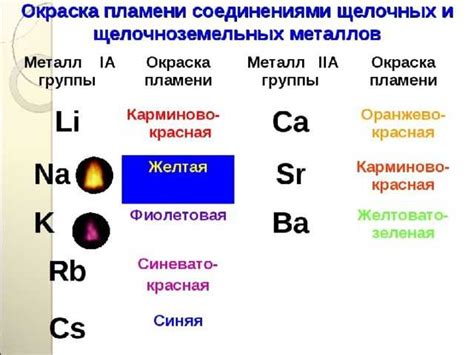
Щелочноземельные металлы – это элементы из второй группы периодической таблицы, которые обладают сходными химическими свойствами. Название "щелочноземельные" они получили из-за способности образовывать гидроксиды с щелочными свойствами при реакции с водой.
Щелочноземельные металлы реагируют с большинством не металлов, образуя соединения с высокой степенью ионизации. Например, они образуют оксиды и гидриды, такие как оксид кальция (CaO) и гидрид магния (MgH2).
Самое известное взаимодействие щелочноземельных металлов – реакция с кислородом. При нагревании они горят с ярким пламенем, образуя оксиды. Например, магний горит, образуя оксид магния (MgO) и избыток кислорода. Также металлы этой группы способны образовывать пероксиды и супероксиды.
Щелочноземельные металлы сильно реагируют с водой, образуя соответствующие гидроксиды и высвобождая водород. Реакция с водой становится более интенсивной с увеличением атомного номера элемента. Например, магний медленно реагирует с водой, а барий реагирует достаточно быстро.
Особое внимание следует обратить на взаимодействие щелочноземельных металлов с кислотами. В таких реакциях образуются соли и выделяется водород. Например, реакция кальция с соляной кислотой приводит к образованию хлорида кальция (CaCl2) и выделению водорода.
Также щелочноземельные металлы могут образовывать соединения с другими элементами, такими как свинец, алюминий, бор, сера и другие. Все эти реакции играют важную роль в различных промышленных процессах и химических реакциях, а также имеют большое значение для жизнедеятельности организмов.
Зачем изучать свойства щелочноземельных металлов

Изучение свойств щелочноземельных металлов имеет важное практическое значение и находит широкое применение в различных областях науки и техники.
Первое и наиболее важное применение свойств щелочноземельных металлов связано с их химической активностью и реакционной способностью. Они способны реагировать с различными веществами, образуя соли, оксиды и гидроксиды. Эти реакции используются в химической промышленности для получения различных продуктов, таких как щелочи, пестициды, лекарственные вещества и другие.
Второе применение свойств щелочноземельных металлов связано с их физическими свойствами. Они обладают хорошей электропроводностью, поэтому широко используются в электротехнике для изготовления проводов и контактов. Кроме того, они обладают низкой плотностью, что делает их полезными материалами для легких конструкций в авиации и космической промышленности.
Третье применение свойств щелочноземельных металлов связано с их биологическими свойствами. Они являются важными микроэлементами для организмов и играют ключевую роль в биохимических процессах. Изучение воздействия щелочноземельных металлов на организмы позволяет разрабатывать новые лекарственные препараты и методы лечения различных заболеваний.
Изучение свойств щелочноземельных металлов позволяет расширить наши знания в области химии, физики и биологии. Оно способствует развитию науки, прогрессу и улучшению нашей жизни. Поэтому изучение свойств этих металлов является важной и перспективной задачей для научного сообщества.
Вопрос-ответ

Почему щелочноземельные металлы называются щелочноземельными?
Щелочноземельные металлы называются так, потому что они образуют основания с щелочными свойствами при реакции с водой.
Какие металлы относятся к классу щелочноземельных?
К классу щелочноземельных металлов относятся бериллий, магний, кальций, стронций, барий и радий.
Почему щелочноземельные металлы образуют основания с щелочными свойствами?
Щелочноземельные металлы образуют основания с щелочными свойствами из-за их низкой ионизационной энергии и способности отдавать два электрона при реакции с водой.
Какие основания образуют щелочноземельные металлы?
Щелочноземельные металлы образуют гидроксиды с щелочными свойствами, например, оксид натрия образует гидроксид натрия, который является щелочным.
