Металлы являются одним из основных типов веществ, которые обладают высокой степенью твердости. Эта особенность связана с их строением на молекулярном уровне. В отличие от других материалов, металлы образуют кристаллическую решетку, которая является основой их прочности и твердости.
Металлическая решетка состоит из множества атомов, которые упорядочены в определенном порядке. Это упорядочение обеспечивает прочность и твердость металлов. Каждый атом в решетке занимает свое место и тесно связан с соседними атомами. Это обеспечивает металлам их характерные механические свойства.
Металлы также обладают высокой плотностью атомов в решетке, что придает им дополнительную прочность. Атомы металла располагаются очень близко друг к другу, что создает прочные связи между ними. Благодаря этому металлы могут выдерживать большие механические нагрузки и сохранять свою форму даже при деформации.
Таким образом, металлы обладают твердостью благодаря своей кристаллической решетке, которая обеспечивает прочность и упорядоченное расположение атомов. Это позволяет им быть одними из самых прочных и твердых материалов в природе.
Прочная молекулярная структура
Одной из причин твердости металлов является их прочная молекулярная структура. Металлы образуют кристаллическую решетку, в которой каждый атом сильно связан с соседними атомами. Эти связи, называемые металлическими связями, обладают высокой прочностью и могут выдерживать большие силы.
Молекулярная структура металлов обеспечивает им устойчивость и упругость. Межатомные связи в кристаллической решетке позволяют металлам сохранять свою форму и противостоять деформации под воздействием внешних сил. Кроме того, прочная молекулярная структура обуславливает высокую точку плавления металлов и способность выдерживать повышенные температуры без разрушения.
Молекулярная структура металлов также способствует их устойчивости к различным физическим и химическим воздействиям. Металлы обладают высокой устойчивостью к коррозии и окислению благодаря своей прочной молекулярной структуре, которая предотвращает разрушение металла под воздействием влаги, кислорода и других химических веществ.
- Молекулярная структура металлов также определяет их свойства проводимости электричества и тепла. Свободные электроны в кристаллической решетке металлов позволяют им проводить электрический ток и передавать тепло.
- Прочная молекулярная структура также обеспечивает металлам высокую механическую прочность. Металлы используются в строительстве, машиностроении и других отраслях промышленности благодаря своей способности выдерживать большие нагрузки и деформации без разрушения.
В целом, прочная молекулярная структура является одной из главных причин твердости металлов и их способности выдерживать различные воздействия. Она обеспечивает металлам устойчивость, прочность и высокие физические и химические свойства.
Твердость обусловлена мощными связями

Твердость металлов обусловлена особыми свойствами их атомов и межатомных связей. В металлической решетке атомы соединены между собой с помощью электронных связей, называемых металлическими связями. Эти связи проявляются благодаря особому строению электронной оболочки металла, которая характеризуется наличием свободных электронов.
Металлы обладают высокой тепло- и электропроводностью, а также пластичностью и твердостью. Прочность металлов обусловлена тем, что при воздействии на материал внешних сил электроны перемещаются и образуют новые связи, препятствующие перемещению атомов металла друг относительно друга.
Межатомные связи в металлах являются сильными и направленными. Это обеспечивает высокую твердость материала. В результате мощных связей и плотной упаковки атомов металлы обладают жёсткостью, способностью сохранять форму и противостоять деформации и разрушению при действии внешних сил.
На твердость металлов также влияет их кристаллическая структура. Благодаря регулярному расположению атомов в кристаллической решетке металлы могут образовывать прочные связи между атомами. Так, например, металлы с кубической кристаллической структурой, такие как железо и алюминий, обладают высокой твердостью и тугоплавкостью.
Симметричная кристаллическая решетка
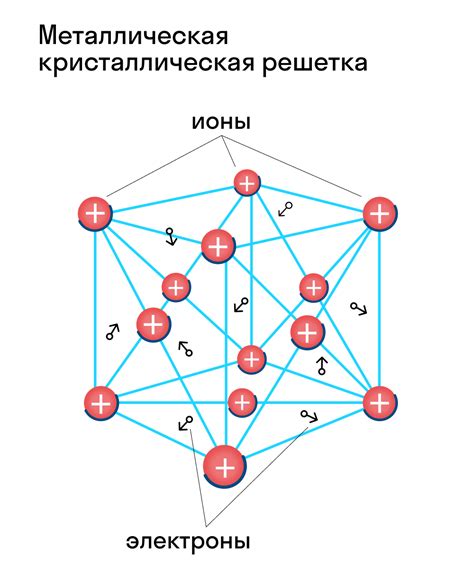
Твердость металлов объясняется их особым атомным строением. Металлы образуют симметричную кристаллическую решетку, которая обеспечивает их механическую прочность и твердость. Атомы металла располагаются в регулярном повторяющемся порядке, образуя сетку. Эта сетка имеет регулярную структуру, которая может быть описана с помощью кристаллической структуры.
Кристаллическая решетка металлов состоит из элементарных ячеек, в каждой из которых расположены атомы. Структура решетки может быть различной в зависимости от металла, но все они имеют общую черту – симметрию. Симметричная кристаллическая решетка делает металлы прочными, так как атомы металла связаны между собой внутренними силами. Это позволяет металлам выдерживать большие нагрузки и обладать высокой твердостью.
В металлах также часто встречается плотная упаковка атомов в решетке. Это означает, что атомы металла плотно упакованы друг к другу и между ними мало свободного пространства. Благодаря этому, металлы обладают высокой плотностью и твердостью. В то же время, свободные электроны, которые находятся в решетке металла, позволяют слоям решетки сдвигаться относительно друг друга, что делает металлы пластичными и деформируемыми.
Металлическая связь

Металлическая связь - особый тип химической связи, характерный для металлов. Она обусловлена взаимодействием металлических атомов друг с другом. Одной из особенностей металлической связи является то, что в ней электроны свободно движутся по металлической структуре, создавая так называемое море электронов.
Металлическая связь обеспечивает металлам их уникальные свойства, включая высокую твердость. Это происходит благодаря взаимодействию электронов металлов с кристаллической решеткой, что создает сильные связи между атомами. Интенсивность металлической связи зависит от степени перекрытия энергетических уровней атомов металла, что также влияет на его твердость.
Металлическая связь также обуславливает способность металлов проводить электрический ток и тепло. Благодаря свободному движению электронов, металлы способны эффективно транспортировать заряды и тепловую энергию внутри своей структуры.
Однако металлическая связь также имеет свои недостатки. В частности, она делает металлы податливыми к деформации и изменениям формы. Благодаря свободному движению электронов, металлические атомы могут смещаться относительно друг друга без разрушения связей, что позволяет металлам принимать различные формы без потери своих свойств.
Делокализованные электроны
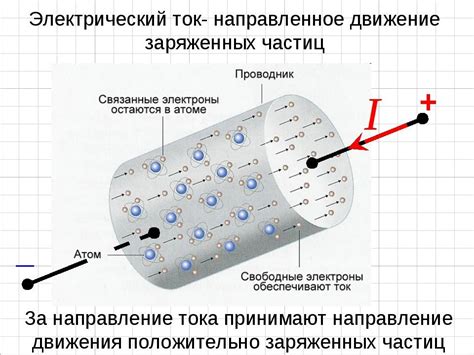
Одной из основных причин твердости металлов является наличие делокализованных электронов. Внутри атомов металлов электроны находятся в свободном состоянии и не привязаны к конкретному атомному ядру. Вместо этого они образуют своеобразное "облако" электронов, которое простирается по всему объему кристаллической решетки.
Эта особенность металлов позволяет им обладать высокой проводимостью электричества и тепла. Благодаря свободному передвижению электронов, металлы способны легко проводить электрический ток и переносить энергию в виде тепла. В то же время, делокализация электронов придает металлам твердость и прочность.
Когда на металлическую решетку действуют внешние силы, делокализованные электроны оказывают сопротивление этому воздействию. Они формируют некое напряжение, которое препятствует деформации решетки и делает металл упругим. В свою очередь, это позволяет металлам сохранять свою форму и устойчивость при механическом воздействии, делая их твердыми и прочными материалами.
Важно отметить, что делокализованные электроны также отвечают за светящиеся свойства некоторых металлов. При возбуждении электроны переходят на высшие энергетические уровни и затем возвращаются на свои места, излучая свет. Этот процесс называется люминесценцией и является одним из свойств, которые делают металлы особенными и полезными в различных областях науки и технологий.
Постоянная связь в кристаллической решетке
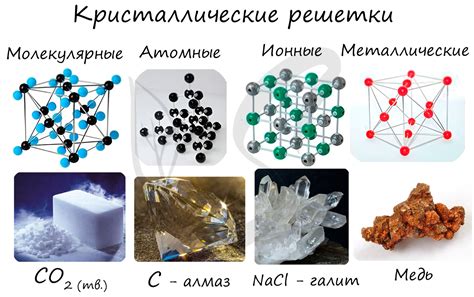
Твердость металлов объясняется особенностями их кристаллической структуры и взаимодействием атомов в решетке. Металлы формируют кристаллическую структуру, в которой атомы располагаются в строго упорядоченном порядке. Это обусловлено постоянной связью между атомами в кристаллической решетке.
Атомы металлов обладают слабыми связями, которые позволяют им двигаться и деформироваться под воздействием внешних сил. Однако, благодаря постоянной связи в кристаллической решетке, атомы восстанавливают свою позицию после изменения формы металла. Это явление называется обратным эффектом деформации.
Кристаллическая решетка металлов обладает высокой упругостью и стойкостью к деформации, что обеспечивает их твердость. Постоянная связь между атомами позволяет металлам сопротивляться смятию, кручению и разрыву, что делает их прочными и прочно держащими форму.
Кроме того, постоянная связь в кристаллической решетке обусловливает малую текучесть металлов. Внутренние связи в кристаллической решетке лишают металлы возможности быстро переходить к жидкому состоянию, что делает их твердыми и стойкими к высоким температурам.
Слоистая структура
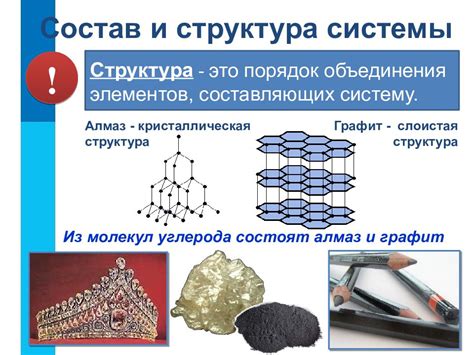
Твердость металлов обусловлена их особой структурой, которую можно описать как слоистую. Данная структура представляет собой регулярное расположение атомов или ионов металла в виде слоев.
Слоистая структура обеспечивает металлам высокую прочность и твердость. Каждый атом или ион металла тесно связан с соседними, образуя прочные связи между слоями. Это позволяет металлам выдерживать большие нагрузки и не деформироваться под действием внешних сил.
Более того, слоистая структура металлов имеет еще одно преимущество - возможность образования различных дефектов и дислокаций внутри слоев. Дефекты и дислокации представляют собой изменения в расположении атомов или ионов в слое, которые могут усилить механические свойства металла и повысить его твердость.
Таким образом, слоистая структура является одной из основных причин металлической твердости. Она позволяет металлам быть прочными, не деформироваться и обладать высокими механическими свойствами.
Слой за слоем укрепляется

Управление твердостью металлов осуществляется путем создания структуры и связей между атомами. Один из факторов, отвечающих за твердость металлического материала, - это его кристаллическая структура. У металлов она обычно состоит из слоев, которые могут быть упакованы в различные решетки.
Кристаллическая решетка металла может быть усиленной путем формирования дополнительных связей и образования слоев, которые блокируют перемещение атомов между ними. Другими словами, каждый слой становится неким преградным барьером для движения атомов внутри металла.
Таким образом, чем больше слоев содержит металл, и чем более крепкими являются связи между атомами внутри этих слоев, тем большую твердость он приобретает. Интерметаллические соединения, такие как сплавы, могут быть еще более твердыми, так как в них образуются несколько слоев различных металлов, связанных друг с другом.
Итак, твердость металлов достигается слой за слоем, укрепляя их кристаллическую структуру и препятствуя движению атомов внутри материала. Это обеспечивает металлическим материалам их характерные свойства - прочность и твердость, которые являются основой их широкого применения в различных сферах нашей жизни.
Вопрос-ответ

Почему металлы обладают твердостью?
Металлы обладают твердостью, потому что их атомы или ионы могут образовывать регулярную и кристаллическую структуру. Эта структура обеспечивает прочность металлов и их способность сопротивлять деформации.
Какая связь между кристаллической структурой металлов и их твердостью?
Кристаллическая структура металлов обусловливает их твердость. В кристаллической решетке металлов атомы или ионы расположены в упорядоченом порядке, что делает металлы прочными и твердыми.
