Металлы первой группы, расположенные слева от таблицы Менделеева, называются щелочными металлами. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Название "щелочные металлы" происходит от их способности образовывать щелочные растворы, т.е. растворы, обладающие щелочной (щелочной) реакцией.
Щелочные металлы характеризуются низкой плотностью, низкой температурой плавления и кипения, а также низкой твердостью. Они обладают серебристо-белым цветом и высокой реакционной способностью. Благодаря этим свойствам, щелочные металлы являются важными элементами в химии и промышленности.
Щелочные металлы образуют ионы с положительным зарядом, так называемые катионы. Они вступают в реакции со многими неорганическими и органическими веществами. Окисление щелочных металлов может сопровождаться высвобождением водорода, образованием гидроксидов и бурильных растворов.
Кроме того, щелочные металлы имеют важное значение как элементы для производства щелочей, кислот, сплавов и промышленных материалов. Они также активно используются в медицине, электронике и других отраслях науки и технологии.
Металлы первой группы: почему они называются щелочными

Металлы первой группы в периодической системе элементов включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они называются щелочными металлами из-за своей высокой химической реактивности и способности образовывать щелочные оксиды и гидроксиды.
Щелочные металлы обладают одной валентной электронной оболочкой, что делает их очень активными химическими элементами. Они имеют низкую электроотрицательность и поэтому с легкостью отдают свой валентный электрон при взаимодействии с другими элементами.
Химическая активность щелочных металлов проявляется в их способности реагировать с водой, кислородом и другими элементами. При реакции с водой они образуют основания, такие как щелочи, поэтому их называют щелочными металлами. Например, при взаимодействии с водой литий образует гидроксид лития (LiOH) и выделяется водород.
Щелочные металлы также проявляют высокую активность в реакциях с кислородом, образуя оксиды. Щелочные оксиды, такие как оксид лития (Li2O) и оксид калия (K2O), обладают щелочными свойствами и могут реагировать с водой.
Таким образом, благодаря своей активности и способности образовывать щелочные соединения, металлы первой группы получили название щелочные металлы.
Причина 1: Активная реактивность
Одной из основных причин, по которой металлы первой группы называются щелочными металлами, является их активная реактивность. Щелочные металлы, такие как литий, натрий, калий и др., легко вступают в химические реакции с другими веществами, особенно с кислородом и водой.
Активность щелочных металлов обусловлена их электронной структурой. У атомов щелочных металлов есть только один электрон во внешней оболочке, что делает их нестабильными и готовыми обменять этот электрон с другими атомами для образования ионов. Это химическое свойство делает металлы первой группы очень активными веществами.
Когда металл первой группы вступает в реакцию с водой, например, образуется щелочь и выделяется водород. Реакция такого рода обильно идет с выделением тепла и водородными пузырьками. Эта живая и раскрывающаяся реакция говорит о высокой активности металлов первой группы и в частности о характерных для них свойствах.
Причина 2: Низкая электроотрицательность
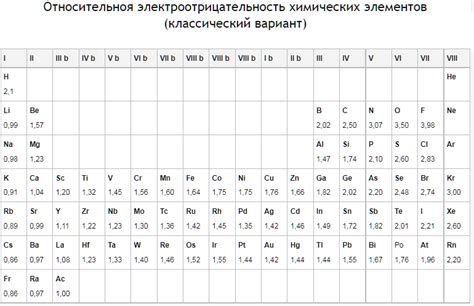
Одной из причин, по которой металлы первой группы называются щелочными металлами, является их низкая электроотрицательность.
Электроотрицательность - это свойство атома притягивать электроны к себе в химической связи. Чем выше электроотрицательность, тем сильнее атом притягивает электроны.
Металлы первой группы, такие как литий, натрий, калий и другие, обладают очень низкой электроотрицательностью. Это означает, что они имеют слабую способность притягивать электроны. Именно поэтому они легко теряют свои валентные электроны и образуют положительно заряженные ионы.
Это свойство щелочных металлов делает их очень реактивными и способными к образованию ионов. Они активно взаимодействуют с другими элементами, особенно с неметаллами, чтобы образовывать соли и другие соединения. Благодаря своей низкой электроотрицательности, металлы первой группы легко участвуют в катионной реакции, что обуславливает их название "щелочные металлы".
Причина 3: Образование гидроксидов
Щелочные металлы первой группы, такие как литий, натрий и калий, образуют сильные гидроксиды. При взаимодействии с водой эти металлы образуют щелочные растворы. Гидроксиды этих металлов – гидроксид лития (LiOH), гидроксид натрия (NaOH) и гидроксид калия (KOH) являются щелочными соединениями, которые растворяются в воде, образуя щелочные растворы.
Гидроксиды щелочных металлов обладают высокой щелочностью и характеризуются высоким pH-значением водных растворов. Это свойство делает их очень полезными в различных областях, таких как химическая промышленность, лабораторная практика, медицина, пищевая промышленность и другие.
Например, гидроксид натрия, также известный как зольная сода или щелочь, используется в процессе мыльного производства, приготовлении стекла, а также в качестве реагента в различных химических реакциях. Гидроксид калия, или щелочь пастильная, применяется в производстве моющих средств, удобрений, аккумуляторов и других продуктов.
Таким образом, образование гидроксидов и их щелочные свойства являются одной из причин, почему металлы первой группы называются щелочными металлами. Эти свойства делают их важными и широко применяемыми в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Какие металлы относятся к первой группе?
К первой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему металлы первой группы называются щелочными?
Металлы первой группы называются щелочными, потому что они реагируют с водой, образуя гидроксид щелочный и выделяя водород. Они также могут образовывать щелочные оксиды и щелочные гидриды.
