Универсальная теория окислительно-восстановительных реакций основана на концепции окислителей и восстановителей. Металлы, как правило, являются хорошими восстановителями, то есть способны отдавать электроны окислителю. Поэтому мы не можем рассматривать их в роли окислителей.
Металлы обладают низкой электрохимической активностью и обычно стремятся набрать электроны, а не отдавать их. Окислитель — это вещество, которое способно принимать электроны от других веществ, при этом само претерпевая восстановление. Восстановитель — это вещество, способное отдавать электроны другим веществам и при этом само окисляться.
Металлы обладают малой электроотрицательностью, что обусловливает их высокую энергию ионизации. Это означает, что металлы не способны эффективно принимать электроны окислителей и, следовательно, не могут действовать в роли окислителей. Таким образом, металлы не могут быть окислителями по определению.
Металлы и окисление: почему происходит окисление металлов

Металлы являются основными источниками электронов и обладают способностью легко отдавать их в окружающую среду. Это явление называется окислением металлов и происходит посредством реакции с кислородом или другими окислительными веществами. Окисленные частицы, полученные от металла, перемещаются в окружающую среду, а металл сам становится ионом с положительным зарядом.
Окисление металлов особенно активно происходит в присутствии кислорода. Под воздействием кислорода металлы образуют оксиды, которые представляют собой связи между металлическим и кислородным ионами. Эти оксиды могут иметь различные степени окисления, что зависит от способности металла отдавать электроны.
Также окисление металлов может происходить в присутствии других окислительных веществ, таких как кислоты, основания и соли. В реакции с кислотами, металлы отдают электроны, образуя соответствующие ионы металла и водород. Если вещество является оксидирующим агентом, то оно способно вступать в реакцию с металлом и отбирать у него электроны, вызывая окисление.
Окисление металлов является неотъемлемой частью их химической реактивности. Металлы применяются в различных сферах, таких как строительство, транспорт, энергетика и другие, в связи с их уникальными физическими и химическими свойствами. Однако, необходимо учитывать их склонность к окислению и предпринимать меры по защите металлических конструкций от коррозии и разрушения, например, покрытием покрытием защитными слоями или использованием специализированных антикоррозийных материалов.
Металлы и их реакция с кислородом
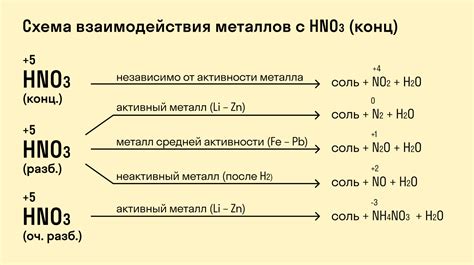
Металлы представляют собой группу элементов, которые обладают хорошей проводимостью электричества и тепла. Но, несмотря на свои уникальные свойства, металлы не могут выступать в роли окислителей в химических реакциях.
Когда металл вступает в реакцию с кислородом, происходит процесс окисления, при котором металл переходит в ионное состояние. Однако, ионизация металла требует большого количества энергии, что делает его непригодным для активной роли окислителя.
Вместо того, чтобы самостоятельно окисляться, металлы образуют соединения с кислородом, обычно в виде оксидов. Эти оксиды обладают различными свойствами и встречаются в природе в большом количестве, например, железо образует оксиды FeO, Fe2O3 и Fe3O4.
Реакция металлов с кислородом является важным процессом, который обуславливает окисление металла и его последующую коррозию. Как правило, металлы, особенно чистые, покрыты защитным слоем оксида, который предотвращает дальнейшее окисление и сохраняет их прочность и структуру.
Электрохимические свойства металлов
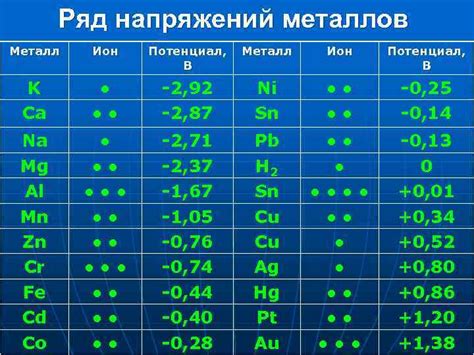
Металлы обладают важными электрохимическими свойствами, которые обуславливают их широкое применение в различных областях. Одной из ключевых характеристик является способность металлов образовывать положительные ионы - катионы. Это обусловлено тем, что в атомах металлов электронная оболочка состоит из малого числа электронов, что делает их склонными к потере электронов и образованию положительных зарядов.
Физические свойства металлов также способствуют их электрохимической активности. Металлы обладают низкой электроотрицательностью, что означает, что они обладают способностью передавать электроны другим веществам. Большинство металлов имеют высокую электропроводность, что позволяет им передавать электроны с высокой скоростью.
Важным электрохимическим свойством металлов является их способность вступать в реакции окисления и восстановления. Металлы могут служить как окислителями, принимая на себя электроны, или как восстановителями, отдавая электроны другим веществам.
Однако, металлы не могут быть окислителями в том смысле, что они не способны вступать в свои же реакции окисления. Это связано с тем, что металлы уже находятся в своем самом высоком окислительном состоянии и не обладают способностью принимать дополнительные электроны. Таким образом, металлы могут действовать только в качестве восстановителей, передавая свои электроны другим веществам.
В заключение, электрохимические свойства металлов обуславливают их способность вступать в реакции окисления и восстановления, что делает их важными компонентами в различных электрохимических процессах.
Термодинамические аспекты окисления металлов
Металлы обладают способностью окисляться, то есть взаимодействовать с кислородом или другими окислителями. Однако, в отличие от неметаллов, металлы не могут выступать в роли окислителей. Это связано с их особыми термодинамическими свойствами.
Во-первых, металлы имеют низкую электроотрицательность, что означает, что они обладают способностью отдавать электроны. Окисление металла представляет собой процесс потери электронов, при этом металл переходит в положительно заряженное ионное состояние. Однако, для того чтобы металл мог служить окислителем, необходимо, чтобы у него была способность принимать электроны. У металлов, в силу их небольшой электроотрицательности, эта способность ограничена.
Во-вторых, термодинамические свойства металлов также ограничивают их способность служить окислителями. Процесс окисления металла связан со снижением энергии и увеличением электронной плотности. Однако, металлы уже обладают высокой электронной плотностью и низкой энергией, поэтому окисление их практически невозможно.
Таким образом, из-за своей низкой электроотрицательности и специфических термодинамических свойств металлы не могут выступать в роли окислителей. Однако, они сами могут окисляться в присутствии окислителей и образовывать положительно заряженные ионы.
Коррозия металлов и окислительные свойства окружающей среды

Коррозия металлов является процессом разрушения материала в результате реакции с окружающей средой. Одним из основных факторов, способствующих разрушению металла, является окисление. Окисление представляет собой реакцию металла с кислородом из воздуха или воды, приводящую к образованию оксидов металла.
Можно сказать, что окисление – это процесс, в ходе которого металл уступает свои электроны, а окислитель – вещество, получающее электроны от металла. В этом смысле металлы не могут быть окислителями, так как они сами отдают свои электроны и окисляются.
Однако окисление металлов может происходить только при наличии окислителя из окружающей среды. Окружающая среда может содержать различные вещества с высокой электроотрицательностью, способные принимать электроны от металла и вызывать его окисление.
Примерами таких окислителей являются, например, кислород, сера, хлор и другие химические соединения. Кроме того, коррозию металлов могут вызывать воздействие влаги или воды, так как вода содержит растворенные в ней газы и минералы, которые могут действовать как окислители.
Таким образом, хотя металлы не могут быть окислителями, они могут быть подвержены окислению при взаимодействии с окислителями в окружающей среде. Для защиты металлов от коррозии необходимо предпринимать меры по предотвращению контакта металла с окислителями, например, путем покрытия металлической поверхности защитными слоями, применения антикоррозионных покрытий или использования других методов защиты от коррозии.
Влияние микроорганизмов на окисление металлов

Микроорганизмы играют важную роль в процессе окисления металлов, так как они способны взаимодействовать с металлами и приводить к их окислительным реакциям. Особенно активное воздействие оказывают такие группы микроорганизмов как бактерии, грибы и археи.
Бактерии являются одними из наиболее известных окислителей металлов. Они способны осуществлять процессы окисления за счет своего метаболического пути, в ходе которого металлы преобразуются в растворимые соединения. Бактериальные окислители металлов широко используются в промышленности для очистки воды и земли от загрязнений металлами.
Грибы, в свою очередь, также способны участвовать в окислительных реакциях металлов. Они могут выделять метаболиты, которые способствуют образованию оксидов металлов. Грибы являются важными участниками экосистем, особенно в почвенной среде, где они способствуют круговороту металлов и их превращению из одной формы в другую.
Археи, хотя и являются меньшинством среди микроорганизмов, также могут принимать участие в окислении металлов. Они обладают специфическими ферментами и пигментами, которые могут участвовать в окислительных процессах металлов. Археи изучаются в научных исследованиях, где исследуются их роль в окислении металлов и их влияние на окружающую среду.
Возможность микроорганизмов воздействовать на окисление металлов открывает широкие перспективы для использования их в различных сферах деятельности. Кроме того, изучение взаимодействия микроорганизмов и металлов может помочь в понимании биогеохимических процессов в природе и разработке методов биоразлагаемого использования металлов.
Окисление металлов и роль гальванических элементов
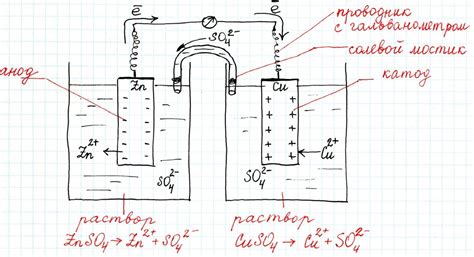
Окисление - процесс, при котором металлы взаимодействуют с окислителями и теряют электроны, становясь положительно заряженными ионами.
Металлы обладают высокой химической активностью, однако они сами по себе не могут быть окислителями. Взаимодействуя с окислителями, металлы выступают в роли веществ, которые отдают электроны и окисляются.
Гальванический элемент является электрохимической системой, в которой происходит окисление и восстановление веществ. Основой гальванического элемента является окислительно-восстановительная реакция, которая сопровождается переносом электронов от одного вещества к другому.
В гальваническом элементе происходит перенос электронов от окисляемого металла (анода) к окислителю через электролит. Электролит представляет собой раствор, в котором находятся ионы веществ, участвующих в окислительно-восстановительной реакции.
Металлы могут участвовать в гальванических элементах как активные или пассивные. Активные металлы более склонны к окислению и выступают в роли анода, отдающего электроны. Пассивные металлы, напротив, имеют более низкую склонность к окислению и используются как катоды, принимающие электроны.
Гальванические элементы широко применяются в различных областях, таких как энергетика, электроника, химическая промышленность. Они служат источниками электрической энергии, а также используются в процессах покрытия металлов для защиты от коррозии.
Металлы и их способность к образованию оксидов

Металлы – это химические элементы, которые имеют склонность отдавать электроны и образовывать положительно заряженные ионы, называемые катионами. При этом металлы могут реагировать с кислородом воздуха и образовывать оксиды.
Оксиды – это химические соединения, состоящие из металлического элемента и кислорода. Металлы способны образовывать различные оксиды в зависимости от своих химических свойств. Например, железо образует оксиды FeO, Fe2O3 и Fe3O4, а алюминий образует оксид Al2O3.
Металлы обладают способностью окисляться – принимать электроны от других веществ и образовывать положительные ионы. Однако, металлы не могут быть окислителями, так как они уже находятся в положительной окислительной степени и не могут принять дополнительные электроны. Таким образом, металлы могут быть только веществами, которые окисляются – теряют электроны в химической реакции.
В реакции с кислородом металлы образуют оксиды, при этом они теряют электроны и окисляются. Эта процесс называется окислением. Возможность образования оксидов связана с тем, что металлы имеют малую электроотрицательность – способность притягивать электроны. Кислород, в свою очередь, имеет высокую электроотрицательность и способен принимать электроны от металлов.
Роль окисления металлов в промышленных процессах

Окисление металлов играет важную роль в различных промышленных процессах, превращая металлические элементы в более стабильные соединения и обеспечивая им дополнительные свойства и функции. Эти процессы могут быть использованы в различных отраслях промышленности, таких как сельское хозяйство, энергетика, электроника, строительство и многих других.
Окисление металлов может происходить как при воздействии внешних факторов, например, воздуха, воды или кислот, так и в результате специально организованных химических процессов. В результате окисления металлы приобретают новые свойства, такие, как устойчивость к коррозии и повышенную прочность. В некоторых случаях окисление может также привести к образованию слоя оксида на поверхности металла, который может служить защитным покрытием.
В промышленности часто применяются процессы окисления металлов для создания новых материалов и изделий. Например, в металлургии окисление металлов может быть использовано для получения сплавов с желаемыми свойствами, такими как прочность, твёрдость или устойчивость к высоким температурам. Окисление металлов может также использоваться для создания покрытий, которые улучшают эстетический вид изделий, защищают их от коррозии или придают им специальные свойства, такие как антибактериальность или проводимость.
Процессы окисления металлов в промышленности могут быть осуществлены различными способами. Некоторые из них включают погружение металлического изделия в специальные растворы, обработку его поверхности с помощью химических соединений или использование электрохимических методов. Контроль окисления металлов в промышленных процессах является важным аспектом для обеспечения качества и надежности конечного продукта. Для этого могут применяться специальные ингибиторы окисления, регулирующие факторы и процедуры.
Вопрос-ответ

Можно ли использовать металлы в качестве окислителей?
Нет, металлы не могут быть использованы в качестве окислителей. Это связано с их электрохимическими свойствами.
Почему металлы не проявляют окислительные свойства?
Металлы не проявляют окислительные свойства из-за своей электрохимической природы. Они обладают высокой силой восстановления и тенденцией отдавать электроны, а не принимать их.
Какие свойства металлов не позволяют им быть окислителями?
Металлы не могут быть окислителями из-за своих свойств: высокой ионизационной энергии, низкой электроотрицательности и низкой электрохимической активности.
Чем отличаются окислители от металлов?
Окислители и металлы отличаются своими электрохимическими свойствами. Окислители способны принимать электроны и окислять вещества, в то время как металлы обладают высокой силой восстановления и отдают электроны, выступая в роли восстановителей.
Какие вещества лучше всего могут быть использованы в качестве окислителей?
Лучше всего в качестве окислителей могут быть использованы вещества с высокой электроотрицательностью и способностью принимать электроны, такие как хлор, бром и йод. Металлы же не подходят для этой роли из-за своей электрохимической природы.
