Металлы являются одной из самых удивительных и важных групп веществ в химии. Их особенностью является способность к восстановлению, то есть способность отдавать электроны и превращаться из положительно заряженных ионов в нейтральные атомы.
Одной из причин, почему атомы металлов обладают восстановительными свойствами, является их электростатическая структура. Атомы металлов имеют небольшое количество электронов в валентной оболочке, что делает их более склонными к отдаче электронов. Они имеют относительно большой радиус, что облегчает выход электронов за пределы атома и их передачу другим частицам.
Другая причина восстановительных свойств атомов металлов заключается в структуре их электронного облака. В металлах электроны могут свободно передвигаться по всему объему вещества без фиксированного положения. Это свободное движение электронов обуславливает возможность электронных переходов и обмена частицами.
Кроме того, атомы металлов могут образовывать ионы с положительным зарядом, которые тяготеют к электронам с отрицательным зарядом. Ионы металлов претерпевают восстановление, когда принимают электроны от незаряженных атомов или отрицательно заряженных ионов, что стабилизирует систему и позволяет атомам металлов обладать восстановительными свойствами.
Процесс восстановления атомов металлов

Атомы металлов обладают восстановительными свойствами, что означает их способность передавать электроны другим атомам или молекулам. Процесс восстановления атомов металлов основан на их электронной структуре и химических свойствах.
Восстановление атомов металлов может происходить в различных химических реакциях, где металл вступает во взаимодействие с веществом, имеющим более высокую степень окисления. В результате этого процесса атом металла отдает свои электроны, что приводит к уменьшению степени окисления и восстановлению атомов вещества к более низкой степени окисления.
Процесс восстановления атомов металлов является важным в различных технологических и химических процессах. Например, в производстве стали, восстановительные реакции применяются для удаления кислорода из железа, чтобы получить более чистый металл. Кроме того, восстановление атомов металлов может также играть роль в электрохимических процессах, таких как электролиз или батареи, где металлы вступают в реакцию с электролитом и переходят из одной степени окисления в другую.
Процесс восстановления атомов металлов может быть регулируемым и контролируемым. Например, это может осуществляться путем подачи электрического тока или добавления вещества, которое способствует восстановлению. В обоих случаях атомы металлов вступают в реакцию с другими веществами с учетом их электронной структуры, что позволяет исполнять различные функции в различных отраслях промышленности и химии.
Ионизация воды

Ионизация воды – это процесс, при котором молекулы воды расщепляются на ионы. Вода состоит из одного атома кислорода и двух атомов водорода, и каждый из этих атомов может ионизироваться.
Ионизация воды происходит под влиянием различных факторов, таких как температура, давление и присутствие ионов в растворе. В результате этого процесса образуются ионы гидроксида (OH-) и ионы водорода (H+).
Ионизация воды играет важную роль в химических реакциях, таких как окислительно-восстановительные реакции. Ионы водорода, образующиеся при ионизации воды, могут выступать в качестве восстановителя, передавая электроны другим веществам. Это объясняет восстановительные свойства атомов металлов.
Ионизация воды также способствует образованию кислот и оснований. Ионы гидроксида, образующиеся при ионизации воды, являются основаниями, а ионы водорода – кислотами. Присутствие этих ионов делает воду слабым электролитом и обеспечивает возможность проведения электрического тока через нее.
- Ионизация воды зависит от pH – уровня кислотности или щелочности раствора. При нейтральном pH количество ионов гидроксида и ионов водорода равно.
- Ионизация воды влияет на ее свойства и возможность реагировать с другими веществами.
Таким образом, ионизация воды играет важную роль в химических процессах и является основой для объяснения многих химических свойств и реакций.
Электронный обмен
Электронный обмен представляет собой процесс переноса электронов между атомами и ионами в химических реакциях. Он играет важную роль во многих физических и химических процессах и является основной причиной восстановительных свойств металлов.
Восстановительные свойства металлов связаны с их способностью отдавать электроны другим реагентам. Металлы имеют низкую электроотрицательность и малую энергию ионизации, что позволяет им легко отдавать свои электроны. При контакте с веществами, имеющими высокую электроотрицательность, металлы переносят свои электроны на атомы этого вещества, что позволяет им восстановить свои положительные заряды.
Электронный обмен между атомами металлов и другими веществами происходит посредством двух основных типов реакций - окислительных и восстановительных. В окислительных реакциях металл отдает электроны и окисляется, а другой компонент вещества принимает электроны и восстанавливается. В восстановительных реакциях металл принимает электроны, тем самым восстанавливая другой компонент вещества.
Электронный обмен является ключевым механизмом, который позволяет металлам проявлять свои восстановительные свойства. Эта способность металлов играет важную роль во многих процессах, например, в производстве металлических изделий, электролизе или в процессе коррозии металлов.
Окислительно-восстановительные реакции
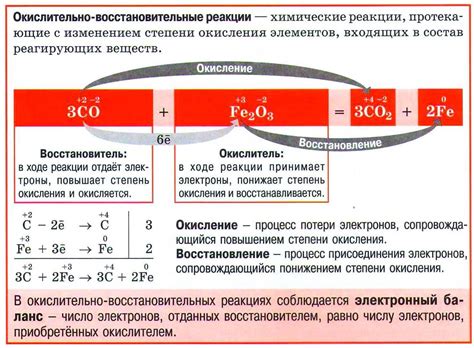
Окислительно-восстановительные реакции (ОВР) – это химические процессы, в которых происходит передача электронов от одного вещества (восстановителя) к другому (окислителю). В результате таких реакций происходит изменение степени окисления элементов.
Восстановитель – это вещество, которое передает электроны другому веществу и сам при этом окисляется. Окислитель – это вещество, которое принимает электроны от восстановителя и сам при этом восстанавливается.
Атомы металлов обладают восстановительными свойствами, поскольку они способны отдавать электроны другим веществам. В процессе ОВР металлы обычно действуют в качестве восстановителей, передавая электроны и изменяя свою степень окисления.
Восстановительные свойства атомов металлов обусловлены особенностями их электронной структуры. Металлы обладают свободными электронами в своей валентной оболочке, которые легко отдаются другим веществам. Это позволяет металлам проявлять свои восстановительные свойства и принимать активное участие в ОВР.
Окислительно-восстановительные реакции широко используются в промышленности, в аналитической химии и в повседневной жизни. Они позволяют получать необходимые продукты, производить электрическую энергию, проводить анализ химических соединений и многое другое.
Вопрос-ответ

Какие свойства делают атомы металлов восстановителями?
Атомы металлов обладают восстановительными свойствами из-за особенностей их электронной структуры. У металлов на внешнем энергетическом уровне находится всего несколько электронов, которые слабо притягиваются ядром. Это позволяет металлам легко отдавать электроны и образовывать ионы положительных зарядов. В результате, металлы могут восстанавливать вещества, получая дополнительные электроны и переходя в ионы с отрицательным зарядом.
Почему атомы металлов способны отдавать электроны другим веществам?
Атомы металлов способны отдавать электроны другим веществам из-за того, что у них между энергетическими уровнями существуют свободные электроны. Эти свободные электроны являются общим резервуаром для электронов атомов металлов. Когда вещество с потенциалом окислителя вступает в контакт с металлом, свободные электроны передаются на внешние энергетические уровни этого вещества, что приводит к его восстановлению.
