Щелочные металлы - это группа элементов периодической системы, которая включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы относятся к первой группе периодической системы и характеризуются своей реактивностью и высокой электроотрицательностью.
Щелочные металлы имеют свойства, которые делают их особенно важными в нашей повседневной жизни. Они обладают высокой электропроводностью, что делает их незаменимыми в производстве батареек и аккумуляторов. Кроме того, они используются в процессе производства щелочного натрона и в производстве различных химических соединений.
Однако щелочные металлы также обладают высокой реактивностью и чувствительностью к воздуху и влаге. Они реагируют с водой, образуя щелочи и выделяя водород. Кроме того, они способны образовывать соединения с кислородом и продуктами горения, что делает их воспламеняемыми. Поэтому при работе с щелочными металлами необходимо соблюдать предосторожность и работать в специально оборудованных помещениях.
Щелочные металлы играют важную роль в нашей жизни и промышленности. Они находят применение в различных областях, таких как электроэнергетика, металлургия, пищевая промышленность и медицина. Благодаря своим особым свойствам и химическим реакциям, щелочные металлы остаются неотъемлемой частью современного мира и продолжают продвигать науку и технологии вперед.
Что такое периодическая система элементов?
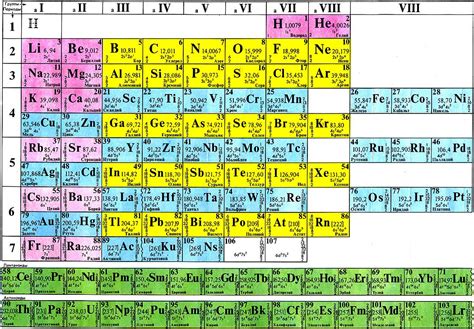
Периодическая система элементов – это упорядоченная таблица, на которой представлены все известные на данный момент химические элементы, расположенные в порядке возрастания их атомных номеров.
Периодическая система элементов представляет собой важный инструмент в химии и физике, а также во многих других науках, связанных с изучением вещества и его свойств.
Основой периодической системы элементов является таблица элементов Менделеева, разработанная русским химиком Дмитрием Менделеевым в 1869 году. Она состоит из 118 элементов, каждый из которых имеет свой уникальный атомный номер, символ и название.
В периодической системе элементов элементы расположены в строки и столбцы. Строки называются периодами, а столбцы – группами. Периоды говорят о том, сколько уровней электронных оболочек содержит атом элемента, а группы показывают количество электронов на внешней электронной оболочке.
Периодическая система элементов позволяет легко ориентироваться в химических свойствах и поведении различных элементов. На основе ее систематики и закономерностей можно делать прогнозы о поведении элементов, а также предсказывать свойства и реактивность еще неизвестных элементов.
Периодическая система элементов является основой для изучения различных химических и физических процессов, а также находит широкое применение в промышленности, медицине, научных исследованиях и других областях науки и техники.
История создания и развития

Периодическая система элементов – это систематизированная таблица, в которой элементы разделены по атомному номеру и химическим свойствам. Основу этой системы составляют металлы, а одной из самых важных групп являются щелочные металлы.
История создания периодической системы началась со взаимозависимости химических свойств элементов. В 1817 году Генри Кавендиш установил, что свойства химического элемента зависят от его атомной массы. Также исследованиями занимались Йоганн Доберейнер и Александр Вавилов – они предложили группировать элементы по их свойствам.
Передача в этой области развития химии была осуществлена в 1869 году русским ученым Дмитрием Менделеевым. Он создал первую таблицу элементов с учетом их атомных масс и настроек. Система Менделеева была основой для модели периодической системы, но с течением времени она была дополнена и изменена другими учеными.
Щелочные металлы – это группа элементов, относящихся к первой группе периодической системы. Они включают литий, натрий, калий, рубидий, цезий и франций. Изначально их называли "абсолютно щелочными металлами", так как они обладают высокой щелочностью и реагируют с водой, образуя щелочные оксиды и гидроксиды.
Структура периодической системы элементов
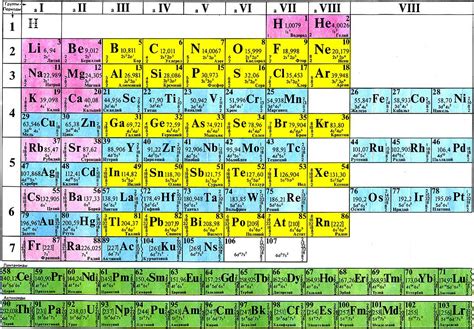
Периодическая система элементов является важным инструментом для организации знаний о химических элементах. Она состоит из таблицы, в которой элементы расположены в определенном порядке. Главной особенностью периодической системы является то, что элементы расположены таким образом, чтобы их физические и химические свойства менялись последовательно с увеличением атомного номера.
Периодическая система элементов состоит из семи периодов, которые представлены горизонтальными рядами, и восемнадцати групп, которые представлены вертикальными столбцами. Каждый элемент в таблице имеет свое место, определенное его атомным номером и химическими свойствами.
Главные группы периодической системы элементов обычно обозначаются римскими цифрами от I до VIII, а также цифрами с 1 по 18. Щелочные металлы, например, находятся в первой группе. Каждая группа характеризуется наличием общих свойств у элементов, находящихся в ней.
Кроме того, периодическая система элементов может быть представлена в виде блоков, которые отображают схожие электронные конфигурации у элементов. Блоки включают s-блок, p-блок, d-блок и f-блок. Щелочные металлы относятся к s-блоку, что означает, что они имеют одни из самых низких энергий и наиболее активные химические свойства среди элементов.
Щелочные металлы в периодической системе

Щелочные металлы - группа элементов, составляющая первую группу в периодической системе химических элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы имеют одно электрон в своей внешней электронной оболочке, что делает их очень реактивными и склонными к образованию ионов положительного заряда.
Щелочные металлы являются мягкими металлами с низкой плотностью. Они обладают низкой температурой плавления и кипения, а также высокой электропроводностью. При взаимодействии с водой щелочные металлы проявляют яркую реакцию, выделяясь газом водородом и образуя щелочные растворы.
Щелочные металлы широко используются в различных областях. Натрий используется в производстве стекла, щелочей и пищевых добавок. Калий является важным компонентом удобрений, а также используется в производстве стекла и мыла. Литий широко применяется в производстве аккумуляторов, лекарственных препаратов и керамики.
Хотя щелочные металлы имеют множество полезных свойств, они также очень реактивны и могут быть опасными при неправильном обращении с ними. Некоторые щелочные металлы, такие как цезий и франций, являются радиоактивными и имеют высокую токсичность.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы – это группа элементов периодической системы, которые находятся в первой группе и обладают химическими свойствами, характерными для щелочей. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие особенности характерны для щелочных металлов?
Основные характеристики щелочных металлов: низкая плотность, низкая температура плавления и кипения, низкие значения теплоемкости и электронегативности. Щелочные металлы обладают высокой реактивностью, что проявляется в их способности реагировать с водой, кислородом и кислотами. Они также обладают высокой проводимостью электричества и тепла.
