Пероксиды щелочных металлов, таких как литий, натрий, калий и другие, представляют собой особую группу химических соединений, которые обладают высокими окислительными свойствами. Известно большое количество пероксидов, которые образуются при сочетании щелочных металлов с кислородом.
Важной характеристикой пероксидов щелочных металлов является их степень окисления, которая определяет количество электронов, передаваемых при окислительно-восстановительных реакциях. Пероксиды щелочных металлов обладают степенью окисления -1, что позволяет им быть сильными окислителями.
Одним из основных свойств пероксидов щелочных металлов является их способность разлагаться с выделением кислорода. При нагревании или при воздействии катализаторов, пероксиды щелочных металлов распадаются на соответствующие окислы и кислород. Это явление широко используется в различных областях, от промышленности до медицины.
Свойства пероксидов щелочных металлов

Пероксиды щелочных металлов относятся к классу неорганических соединений, которые содержат оксидоредукционный центр в виде пероксидной группы (-O-O-). Эти соединения обладают рядом характеристических свойств, которые определяют их применение и роль в различных процессах.
1. Химическая активность: Пероксиды щелочных металлов обладают высокой химической активностью, что обусловлено наличием пероксидной группы. Они способны взаимодействовать с различными соединениями и молекулами, проявляя окислительные свойства в реакциях с восстановителями.
2. Окислительные свойства: Пероксиды щелочных металлов способны окислять другие вещества, передавая кислородные атомы. Они часто используются в качестве окислителей в различных процессах, таких как окисление органических соединений или активация катализаторов.
3. Реакция с кислотами: Пероксиды щелочных металлов реагируют с кислотами, образуя соответствующие соли и воду. Эта реакция происходит в результате образования кислоты пероксидного типа, которая разлагается с образованием соли и воды.
4. Биологическая активность: Пероксиды щелочных металлов обладают биологической активностью, что позволяет им использоваться в медицине и фармакологии. Некоторые пероксиды щелочных металлов обладают антимикробными свойствами и используются в качестве антисептиков и дезинфицирующих средств.
5. Физические свойства: Пероксиды щелочных металлов обычно являются кристаллическими соединениями, растворимыми в воде. Они обладают высокой плотностью и температурой плавления, а также могут быть стабильными при повышенных температурах и в большом диапазоне pH.
Таким образом, пероксиды щелочных металлов обладают рядом уникальных свойств, которые определяют их применение в различных областях науки и промышленности. Их химическая активность, окислительные свойства, реакция с кислотами, биологическая активность и физические свойства делают их важными компонентами в различных процессах и технологиях.
Физические свойства пероксидов

Пероксиды щелочных металлов обладают рядом характерных физических свойств. Они представляют собой белые кристаллические вещества, обладающие высокой степенью растворимости в воде. Это позволяет легко получать растворы пероксидов щелочных металлов для дальнейшего использования. Как правило, пероксиды образуют кристаллы в форме пластинок или игл, обладающих хорошей прозрачностью.
Один из самых уникальных физических свойств пероксидов – их способность гореть. Пероксиды щелочных металлов являются сильными окислителями, поэтому при взаимодействии с органическими веществами они могут вызывать сильное горение. Благодаря этой особенности пероксиды щелочных металлов широко используются в пиротехнике и в качестве окислителей в различных процессах химической промышленности.
Кроме того, пероксиды обладают высокой термической стабильностью. Они могут выдерживать высокие температуры без разложения или изменения своих химических свойств. Это делает пероксиды щелочных металлов удобными для использования в высокотемпературных процессах и как стабилизаторы окислительной среды.
Некоторые пероксиды, например пероксид калия, могут обладать также амфотерными свойствами. Это означает, что они реагируют как с кислотами, так и с щелочами, дают соли и воду. Такие пероксиды могут использоваться в качестве универсальных реагентов при проведении реакций в амфотерных условиях.
Химические свойства пероксидов

Пероксиды представляют собой химические соединения, которые включают в своей структуре одно или несколько атомов кислорода с дополнительными атомами других элементов. Они обладают выраженным окислительным свойством и, соответственно, являются сильными окислителями.
Одной из основных характеристик пероксидов является их способность образовывать свободные радикалы, которые могут приводить к химическим реакциям разложения пероксида. Пероксиды встречаются в различных промышленных процессах, а также в живой природе, и могут быть как полезными, так и вредными веществами.
К примеру, пероксиды щелочных металлов обладают сильным окислительным действием и могут приводить к воспламенению при контакте с органическими веществами. Они также могут вызывать разложение многих органических соединений, что делает их важными веществами в химической промышленности.
Другим важным свойством пероксидов является их способность кислорода восстанавливаться, что позволяет им действовать как окислители в реакциях окисления-восстановления. Это свойство пероксидов используется в различных процессах, например, в производстве белья, при отбеливании или в качестве катализаторов в реакциях окисления органических соединений.
В целом, химические свойства пероксидов определяются их структурой и составом. Они могут быть как стабильными и безопасными соединениями, так и очень активными, что делает их важными объектами изучения в химии и применения в различных отраслях науки и промышленности.
Возможные степени окисления пероксидов
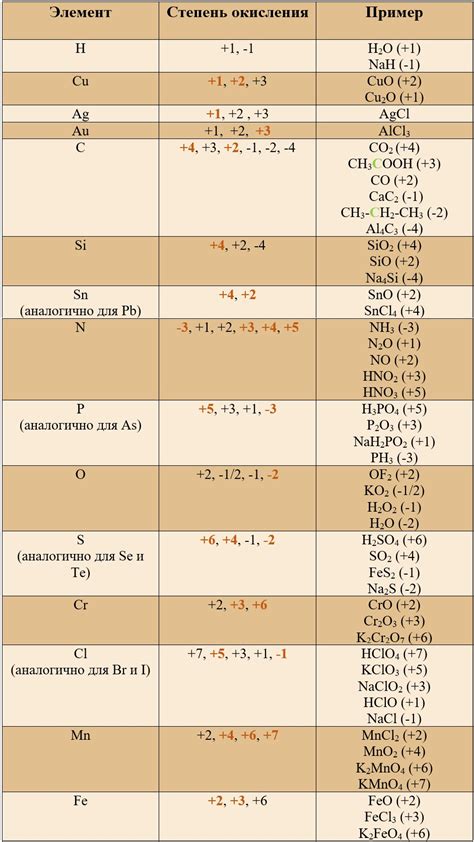
Пероксиды щелочных металлов - это соединения, в которых в структуре присутствует два атома кислорода, связанных друг с другом. Эти соединения могут иметь различные степени окисления, что зависит от электронной структуры и химического окружения металла.
Пероксиды щелочных металлов могут иметь степень окисления -1, когда электронная структура металла полностью передается на кислородные атомы и металл принимает однозарядное положительное состояние. Примером такого пероксида является пероксид натрия (Na2O2).
Однако, пероксиды также могут иметь и более высокие степени окисления, например, +1. В этом случае, пероксид содержит два катиона щелочного металла, один из которых находится в положительном двухзарядном состоянии, а второй - в одноузлном отрицательном состоянии. Пример такого пероксида - пероксид калия (K2O2).
Обычно пероксиды щелочных металлов имеют нестабильную структуру и склонны к разложению при взаимодействии с водой или другими веществами. При этом легко возможно образование пероксидных радикалов, которые обладают очень высокой активностью и способны вызывать окислительные процессы.
Итак, пероксиды щелочных металлов могут иметь степень окисления -1 или +1, что связано с электронной структурой атомов кислорода и металла, а также с их взаимодействием друг с другом. Знание возможных степеней окисления пероксидов позволяет более полно понять их химические свойства и применение в различных областях науки и промышленности.
Реакции пероксидов щелочных металлов с другими веществами
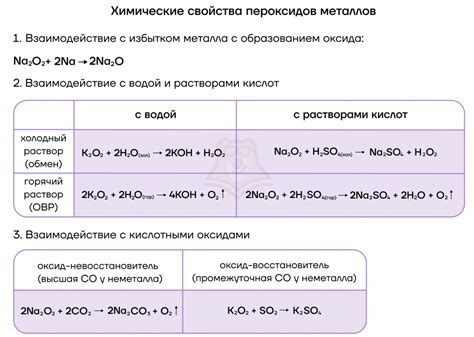
Реакции пероксидов щелочных металлов с водой: Пероксиды щелочных металлов (например, пероксид натрия или пероксид калия) реагируют с водой, образуя гидроксиды щелочных металлов и молекулярный кислород. Эти реакции могут происходить как взрывоопасными, так и спокойными способами, в зависимости от условий.
Реакции пероксидов щелочных металлов с кислотами: Пероксиды щелочных металлов реагируют с кислотами, образуя соли и молекулярный кислород. Эти реакции также могут происходить взрывоопасно, особенно с концентрированными кислотами.
Реакции пероксидов щелочных металлов с органическими веществами: Пероксиды щелочных металлов могут реагировать с органическими веществами, такими как спирты, алдегиды, кетоны и другие. В результате образуются гидроксиды щелочных металлов, органические пероксиды и другие продукты. Эти реакции могут быть полезными для синтеза органических соединений.
Реакции пероксидов щелочных металлов с металлами: Пероксиды щелочных металлов могут реагировать с некоторыми металлами, особенно активными металлами, такими как алюминий и магний. В результате таких реакций могут образоваться соответствующие соли щелочных металлов и оксиды или гидроксиды других металлов.
Реакции пероксидов щелочных металлов с перекисью водорода: Пероксиды щелочных металлов могут реагировать с перекисью водорода, образуя соответствующие гидроксиды щелочных металлов и молекулярный кислород. Эти реакции также могут происходить взрывоопасно, особенно при высоких концентрациях пероксидов.
Реакции пероксидов щелочных металлов с оксидами: Пероксиды щелочных металлов могут реагировать с оксидами металлов, образуя гидроксиды щелочных металлов и соответствующие соли. Эти реакции могут быть использованы для получения гидроксидов щелочных металлов или солей для различных промышленных и научных целей.
Реакции пероксидов щелочных металлов с солями: Пероксиды щелочных металлов могут реагировать с различными солями, образуя гидроксиды щелочных металлов и соответствующие соли. Эти реакции могут быть использованы для получения гидроксидов щелочных металлов или солей для применения в различных областях, таких как химическая промышленность или лабораторная практика.
Вопрос-ответ

Какие свойства имеют пероксиды щелочных металлов?
Пероксиды щелочных металлов обладают ярко выраженным окислительным свойством. Они способны сжигать органические вещества и принимать на себя несколько электронов от веществ с низким окислением. Пероксиды щелочных металлов также обладают высокой теплостойкостью, химической стабильностью и хорошей растворимостью в воде.
Какая степень окисления имеют пероксиды щелочных металлов?
Пероксиды щелочных металлов имеют степень окисления -1. Это означает, что каждый атом щелочного металла в пероксиде имеет одно электронное окисление и два электронных окружения с двумя кислородными атомами. Такая степень окисления позволяет пероксидам щелочных металлов быть мощными окислителями в химических реакциях.
Какие продукты образуют перекиси щелочных металлов при разложении?
При разложении пероксидов щелочных металлов образуются газообразный кислород и гидроксиды щелочных металлов. Например, перекись водорода (H2O2) при разложении образует кислород (O2) и воду (H2O). Таким образом, при разложении перекисей щелочных металлов происходит выделение кислорода.
