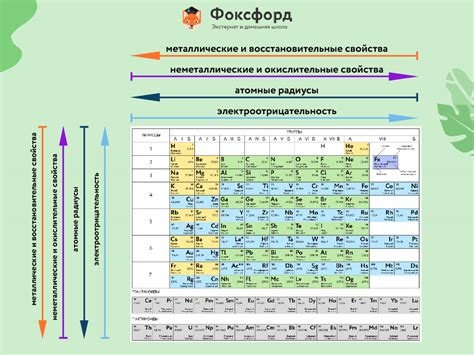
Периодическая характеристика элемента металла представляет собой совокупность свойств, которые зависят от его положения в таблице Менделеева и межатомные взаимодействия. Эта характеристика позволяет нам лучше понять и классифицировать химическую активность, физические свойства и состояние элемента.
Важным свойством металлов является их способность проводить электричество. Это объясняется наличием свободных электронов, которые могут передвигаться внутри металлической решетки. Чем дальше элемент находится в таблице Менделеева от газа, тем менее металлические свойства у него выражены.
Также периодическая характеристика элемента металла включает в себя его электроотрицательность. Этот параметр показывает, насколько элемент может притягивать электроны в химических соединениях. Металлы имеют низкую электроотрицательность, что делает их склонными к отдаче электронов и образованию положительных ионов.
Химические свойства элемента металла
Реакция с водой: Большинство металлов реагируют с водой, образуя гидроксиды и выделяя водород. Некоторые металлы, такие как калий и натрий, проявляют очень активную реакцию, сопровождающуюся искрением и выделением гидроксида и водорода. Другие металлы, такие как алюминий и цинк, тоже реагируют с водой, но медленнее и без искрения.
Реакция с кислотами: Многие металлы реагируют с кислотами, выделяя водород и образуя соли. Например, железо реагирует с соляной кислотой, образуя хлорид железа и выделяя водород. Реактивность металлов с кислотами может быть разной в зависимости от их электрохимического потенциала.
Восстановительные свойства: Металлы имеют способность восстанавливать другие вещества. Например, цинк может восстанавливать ионы меди в химических реакциях, образуя осадок меди и сам окисляясь. Такие реакции широко применяются в химии и металлургии.
Реакция с кислородом: Металлы обладают различной способностью реагировать с кислородом воздуха. Некоторые металлы, такие как медь и серебро, не реагируют с кислородом при обычных условиях. Другие металлы, такие как железо и алюминий, окисляются при контакте с воздухом и покрываются оксидным слоем.
Температурная устойчивость: Многие металлы обладают высокой температурной устойчивостью. Они могут выдерживать высокие температуры без изменения своих химических свойств. Некоторые металлы, такие как платина, исключительно стойки к высоким температурам и широко используются в промышленности.
Ионные свойства: Металлы могут образовывать положительно заряженные ионы, которые способны вступать в химические реакции с другими веществами. Они могут образовывать соединения с отрицательно заряженными ионами, образуя соли и другие соединения. Ионные свойства металлов играют важную роль во многих жизненных процессах и технологических процессах.
Химическая активность металла

Химическая активность металла - это способность металлического элемента вступать в химические реакции с другими веществами. Она определяется энергетическими и электрохимическими свойствами металла. Химическая активность металла является одной из основных характеристик, определяющих его поведение в химических процессах.
Металлы обладают высокой химической активностью и легко вступают в реакции с кислотами, щелочами, галогенами и другими химическими соединениями. Они способны образовывать ионы металла, электронный обмен с другими веществами и участвовать в реакциях окисления-восстановления.
Химическая активность металла может быть оценена по его электрохимическому потенциалу, который определяет его способность отдавать или принимать электроны в реакциях окисления-восстановления. Металлы с более низким электрохимическим потенциалом обладают более высокой химической активностью и легко окисляются, а металлы с более высоким потенциалом обладают более низкой активностью и сложнее окисляются.
Наиболее активные металлы в периодической системе - щелочные металлы, такие как литий, натрий, калий и другие. Они реагируют с водой, кислотами и другими веществами с выделением большого количества тепла и образованием гидроксидов металла.
Металлы средней активности включают металлы переходных элементов, такие как железо, медь, цинк и другие. Они могут вступать в реакции с кислородом, кислотами и другими веществами, но их активность не так высока, как у щелочных металлов.
Наиболее низкую активность проявляют благородные металлы, такие как золото, платина, серебро и другие. Они обладают химической инертностью и практически не реагируют с другими веществами.
Способность образовывать ионы

Способность образовывать ионы – это характеристика электронной структуры металлических элементов, определяющая их способность образовывать положительно заряженные ионы.
При взаимодействии металлических элементов с другими веществами происходит передача электронов. В результате этого процесса металлы, имеющие малую энергию ионизации, могут легко отдавать электроны и образовывать положительно заряженные ионы – катионы.
Способность образовывать ионы зависит от таких факторов, как электронная конфигурация, энергия ионизации и радиус атома металла. Например, металлы с высокой энергией ионизации и малым радиусом образуют сложные ионы, состоящие из нескольких атомов.
Способность образовывать ионы может быть представлена в виде таблицы, в которой указываются ионы металлов, их положительный заряд и примеры соединений. Например, металл натрий (Na) образует ион Na+, а металл кальций (Ca) образует ион Ca2+.
| Металл | Ион | Пример соединения |
|---|---|---|
| Натрий (Na) | Na+ | NaCl (хлорид натрия) |
| Кальций (Ca) | Ca2+ | CaCO3 (карбонат кальция) |
| Магний (Mg) | Mg2+ | Mg(OH)2 (гидроксид магния) |
Таким образом, способность образовывать ионы является важной характеристикой металлических элементов, определяющей их химические свойства и взаимодействие с другими веществами.
Физические свойства элемента металла

Металлы – это класс химических элементов с определенными физическими свойствами. Вот некоторые из основных физических характеристик металлов:
- Проводимость электричества и тепла. Металлы обладают высокой проводимостью как электричества, так и тепла. Это физическое свойство делает металлы необходимыми для проводов, электрических цепей и других электронных устройств.
- Малая теплоемкость. Металлы нагреваются и охлаждаются быстро, благодаря своей малой теплоемкости. Это свойство позволяет использовать металлы в таких областях, как жаропрочная техника и охлаждение электроники.
- Гибкость и пластичность. Металлы отличаются высокой гибкостью и пластичностью, что позволяет им быть легко деформируемыми без разрушения. Это позволяет использовать металлы для создания различных конструкций и формирования сложных деталей.
- Металлический блеск. Металлы обладают ярким и отражающим блеском, который способствует их эстетической привлекательности. Благодаря этому свойству металлы широко используются в ювелирном деле и декоративных элементах.
Таким образом, физические свойства металлов делают их уникальными и важными в различных областях нашей жизни, включая науку, технологии, производство и дизайн.
```
Электропроводность металла
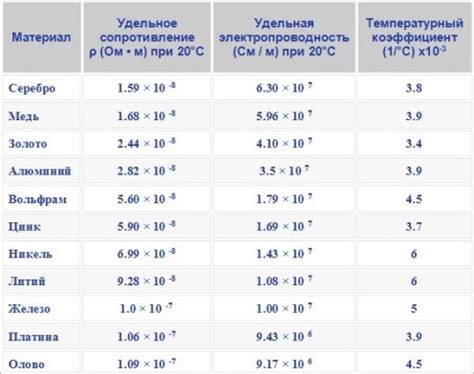
Металлы отличаются высокой электропроводностью, что является одним из их основных свойств. Они способны эффективно проводить электрический ток благодаря особенностям их строения и поведения электронов.
Строение металлов характеризуется наличием свободных электронов в энергетической зоне проводимости. Эти свободные электроны могут свободно двигаться по кристаллической решетке металла без серьезных препятствий с другими атомами. Благодаря этому, металлы обладают высокой электропроводностью и способны легко передавать электрический ток.
Основным механизмом электропроводности в металлах является электронная проводимость. Свободные электроны передают электрический заряд от одного атома к другому, образуя электрический ток. Кроме того, металлы обладают также ионной проводимостью - движение ионов в решетке металла, однако электронная проводимость является главной и доминирующей формой проводимости у большинства металлов.
Высокая электропроводность металлов находит широкое применение в различных сферах науки и техники. Они используются в производстве электрических проводов и кабелей, электрических контактов, электронных компонентов, теплоотводов и других устройств, где требуется эффективная передача электрического тока.
```
Теплопроводность металла
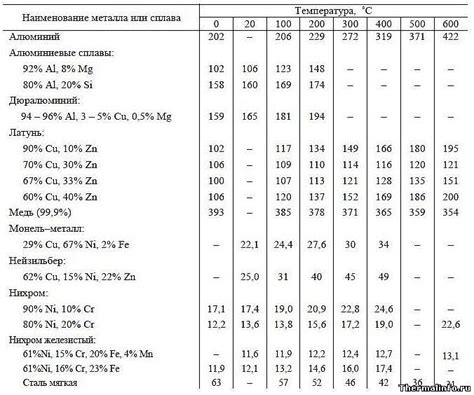
Теплопроводность — это свойство вещества передавать теплоту от одной части к другой путем конвекции, кондукции или излучения. Теплопроводность металла является одним из важнейших физических свойств, определяющих его использование в различных отраслях промышленности и научных исследованиях.
Крупные металлы, такие как железо, алюминий, медь, отличаются высокой теплопроводностью. Это связано с особенностями строения и связи атомов в кристаллической решетке металлического материала. Между атомами существуют свободные электроны, которые перемещаются в металле и передают тепловую энергию.
Металлы с хорошей теплопроводностью широко применяются в производстве теплообменников, радиаторов, электронных компонентов и других устройств, требующих эффективного отвода лишнего тепла. Также теплопроводность металла влияет на его способность быстро нагреваться и охлаждаться, что важно для процессов нагрева и охлаждения в промышленности и бытовой сфере.
Теплопроводность металла зависит от его физических и химических свойств. К примеру, обычная медь обладает теплопроводностью приблизительно в 30 раз выше, чем у обычного стекла. Также, свойства металла могут быть изменены путем специальной обработки, что позволяет повысить или понизить его теплопроводность в зависимости от конкретных задач.
Таким образом, теплопроводность металла является важной характеристикой, которая определяет его использование в различных сферах жизни, и совершенствование этого свойства может привести к созданию более эффективных теплообменных устройств и инженерных решений.
Пластичность металла

Пластичность – это способность материала деформироваться без разрушения под действием внешних нагрузок и сохранять новую форму после прекращения воздействия. Металлы являются одними из наиболее пластичных материалов, что делает их востребованными в различных отраслях промышленности.
Одним из факторов, влияющих на пластичность металла, является его строение на микроуровне. В металлах имеется кристаллическая решетка, которая позволяет атомам свободно перемещаться друг относительно друга. Это обеспечивает пластичность материала и способность к деформации. При деформации металла атомы сдвигаются, меняя свои положения в кристаллической решетке, но остаются связанными друг с другом.
Причина пластичности металлов лежит в особенностях их атомной структуры и связывающих сил.
Пластичность металла является важным свойством при его обработке, так как позволяет проводить различные операции по штамповке, ковке, вытягиванию и прокатке. Эти процессы основаны на способности металла подвергаться пластической деформации без разрушения.
У металлов есть понятие "предел текучести", который характеризует их пластичность. Предел текучести – это максимальная нагрузка, которую металл может выдерживать, сохраняя пластичность. Если нагрузка превышает предел текучести, то металл начинает разрушаться и теряет пластичность.
Определение пластичности металла используется при выборе материалов для конструкций, где требуется гибкость и способность к деформации. Также это свойство учитывается при разработке специальных сплавов с повышенной пластичностью для конкретных задач и условий эксплуатации.
Периодические закономерности в характеристике элементов металла
Периодическая характеристика элементов металла проявляется в определенных закономерностях, связанных с их атомными и физическими свойствами. Одной из основных закономерностей является периодический закон Д.И. Менделеева. Этот закон утверждает, что свойства элементов металла повторяются через определенные промежутки, или периоды, при увеличении их атомных номеров.
Все элементы металла имеют общую группу свойств, таких как хорошая электропроводность и теплопроводность. Однако, внутри этой общей группы можно выделить различные подгруппы элементов металла, каждая из которых обладает своими характеристиками. Например, переходные металлы обладают большей вариабельностью в своих химических реакциях, а щелочные металлы характеризуются высокой реактивностью.
Еще одной периодической закономерностью в характеристике элементов металла является периодическая таблица Менделеева. Эта таблица представляет элементы металла в порядке увеличения атомного номера и позволяет систематизировать их свойства. В таблице элементы расположены в определенных периодах и группах, которые отражают их химическую активность и физические характеристики.
Также, в периодической характеристике элементов металла можно выделить такую закономерность, как увеличение атомного радиуса при переходе от верхнего левого угла таблицы к нижнему правому. Это связано с увеличением количества электронов в атоме, что ведет к увеличению размера атома.
Таким образом, периодические закономерности в характеристике элементов металла отражаются в их атомных и физических свойствах, а также проявляются через периодический закон Д.И. Менделеева и таблицу Менделеева. Изучение этих закономерностей позволяет лучше понять и классифицировать элементы металла в соответствии с их химическими и физическими характеристиками.
Вопрос-ответ

Что такое периодическая характеристика элемента металла?
Периодическая характеристика элемента металла это свойство, которое повторяется в периоде элементов таблицы Менделеева. Она отражает особенности строения атома и электронной структуры элемента, а также его химические свойства.
Какая периодическая характеристика элементов металлов рассматривается в статье?
В статье рассматривается атомный радиус — периодическая характеристика металлов. Это физическая величина, которая определяет расстояние от центра ядра атома до последнего электрона в его электронной оболочке.
Как периодические характеристики элементов металлов используются в научных исследованиях?
Периодические характеристики элементов металлов используются в научных исследованиях для анализа и классификации элементов, а также для предсказания их свойств и реакций. Это позволяет ученым лучше понять и объяснить законы химических реакций и строение вещества.
Как периодическая характеристика элемента металла может влиять на его свойства?
Периодическая характеристика элемента металла может влиять на его свойства, такие как электропроводность, термическая и электронная проводимость, плотность и температура плавления. Например, атомный радиус может влиять на связь между атомами в кристаллической решетке металла и его механические свойства.
