Переходные металлы - это группа элементов в таблице химических элементов, которые расположены между щелочными и щелочноземельными металлами. Они обладают некоторыми уникальными свойствами, которые обусловлены особенностями их электронного строения.
Основной особенностью переходных металлов является наличие в их атомах внутренней электронной оболочки, называемой f-подобной оболочкой. Эта оболочка состоит из серии подуровней d- и f-орбиталей, которые имеют различные энергетические уровни. Именно наличие этих оболочек придает переходным металлам их характерные свойства, такие как яркость цветов, хорошая термическая и электрическая проводимость, а также способность образовывать соединения с различной степенью окисления.
Переходные металлы также обладают свойствами, которые отличают их от других групп элементов. Их атомы могут иметь разные степени окисления, что позволяет им образовывать соединения с различными валентностями. Кроме того, переходные металлы образуют комплексные соединения, в которых их атомы связываются с атомами других элементов через координационные связи, образуя стабильные структуры.
Переходные металлы играют важную роль в различных областях науки и технологий. Они являются неотъемлемой частью множества химических соединений и материалов, используемых в промышленности, медицине, электротехнике и других отраслях. Понимание особенностей электронного строения переходных металлов позволяет разработать эффективные методы синтеза новых материалов с заданными свойствами и улучшить существующие технологии и процессы.
Что такое переходные металлы?
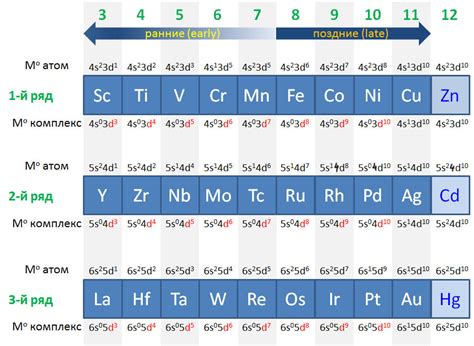
Переходные металлы - это группа химических элементов, которые находятся в середине периодической таблицы. Они характеризуются наличием внутренней (d-) оболочки электронов, которая не является полностью заполненной. На диаграмме энергетического уровня эти элементы находятся между главными группами и представлены блоками d-элементов от скандия (Sc) до цинка (Zn) и блоками f-элементов, называемых актиноидами.
Основная характеристика переходных металлов - это их способность образовывать стабильные соединения с другими элементами и соединения с переменной степенью окисления. Это связано с их особенным электронным строением, где электроны на d-оболочке имеют свободные и изменяемые энергетические уровни, что обуславливает возможность образования соединений в различных степенях окисления.
Переходные металлы обладают также характерными физическими свойствами, например, высокой термо- и электропроводностью, магнитными свойствами и способностью образовывать комплексные соединения. Эти свойства обусловлены их электронным строением и способностью формировать различные обменные соединения с окружающими элементами.
Переходные металлы: общие характеристики
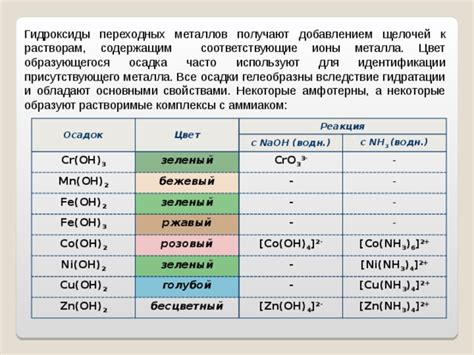
Переходные металлы - это элементы среднего периодического ряда, расположенные между сырцами и парами в таблице Менделеева. Основной особенностью переходных металлов является наличие неполной внешней электронной оболочки, что делает их податливыми к образованию химических связей с другими элементами и обеспечивает им характеристики перехода между металлами и неметаллами.
Одним из главных свойств переходных металлов является их способность образовывать соединения с различными степенями окисления. Это означает, что они могут образовывать ионы с разным количеством потерянных или приобретенных электронов. Из-за этого переходные металлы часто обладают яркими окрасками, которые обусловлены переходами электронов между энергетическими уровнями.
Переходные металлы также проявляют высокую химическую активность и способность образовывать координационные соединения. Их электронная конфигурация позволяет им образовывать комплексы с атомами или ионами других веществ, где переходный металл служит центральным атомом, вокруг которого располагаются лиганды - атомы или ионы, образующие соединение с металлом.
Из-за своих особых свойств переходные металлы имеют широкое применение в промышленности и технологиях. Их способность образовывать каталитические соединения позволяет использовать их в процессах синтеза химических соединений и производства различных материалов. Они также используются в производстве сплавов и металлических конструкций благодаря своим механическим свойствам и электропроводности.
Электронное строение переходных металлов
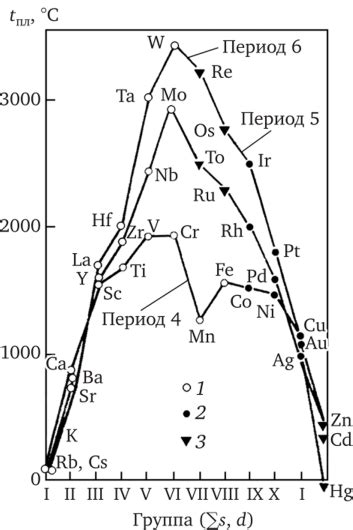
Переходные металлы - это элементы, которые находятся в середине таблицы периодических элементов. Эти элементы имеют особенности своего электронного строения, которое определяет их химические и физические свойства.
Переходные металлы отличаются от других элементов тем, что у них внутренние электронные оболочки не заполнены полностью. Внешние электронные оболочки переходных металлов содержат от одного до двух электронов, что делает их нейтральными или положительно заряженными ионами. Это позволяет переходным металлам образовывать соединения с различными элементами и проявлять свои химические свойства.
Электронное строение переходных металлов можно представить в виде электронной конфигурации. Например, у железа (Fe) электронная конфигурация будет 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Последние электроны внешней оболочки называются d-электронами, и именно они определяют химические свойства переходных металлов.
Одной из особенностей электронного строения переходных металлов является изменчивость их окислительных состояний. Переходные металлы могут образовывать ионы с различным числом зарядов, что позволяет им образовывать соединения с различными элементами и проявлять разнообразие химических свойств. Кроме того, переходные металлы могут образовывать комплексные соединения с другими веществами, в которых металл связывается с атомами лигандов через свои d-электроны.
В целом, электронное строение переходных металлов определяет их способность к образованию соединений, их химические свойства и реактивность. Эти элементы играют важную роль в химической промышленности, технологии и различных приложениях, благодаря своим уникальным химическим свойствам, вызванным их специальным электронным строением.
Доли различных энергетических уровней
Энергетические уровни переходных металлов являются ключевыми компонентами их электронного строения. В основном, эти уровни характеризуются различными долями заполнения электронами.
Переходные металлы имеют большое количество различных энергетических уровней, которые образуют разделенные энергетические подуровни. Доли заполнения этих уровней определяют химические и физические свойства данных элементов.
Энергетические уровни переходных металлов часто обозначаются символами s, p, d и f, соответствующими подуровням в электронной оболочке атома. В основном, d-подуровни являются наиболее полностью заполненными в переходных металлах, в то время как s- и p-подуровни могут быть заполнены частично или полностью.
Доли различных энергетических уровней в электронном строении переходных металлов играют ключевую роль в их реактивности и способности образовывать комплексные соединения. Например, неполная заполненность d-подуровней обусловливает способность переходных металлов образовывать окрашенные соединения и демонстрировать каталитическую активность.
Особенности электронной конфигурации переходных металлов

Переходные металлы – это элементы д-блока таблицы Менделеева, у которых в электронной оболочке присутствуют неполностью заполненные d-орбитали. Их электронная конфигурация отличается от конфигурации основных групп элементов и обладает рядом особенностей.
Переходные металлы имеют возможность образовывать соединения с различными степенями окисления. Это обусловлено особенностью их электронной конфигурации, в которой d-орбитали заполняются последовательно по два электрона. Таким образом, переходные металлы могут потерять или приобрести один или два электрона, образуя ионы с различными степенями окисления.
Электронная конфигурация переходных металлов также обуславливает их ярко выраженные катионообразующие свойства. Неполностью заполненные d-орбитали способствуют образованию положительно заряженных ионов. Присутствие свободных d-электронов включает переходные металлы в реакции окислительно-восстановительных процессов и обеспечивает их активность в химических реакциях.
Также стоит отметить, что электронная конфигурация переходных металлов позволяет им образовывать различные координационные соединения. Они способны образовывать комплексы с легкими и тяжелыми элементами, а также с анионами и нейтральными соединениями. Это связано с возможностью образования дополнительных связей d-электронов с другими элементами, что обуславливает их способность к координационной химии.
Взаимодействие с другими элементами

Переходные металлы обладают способностью образовывать соединения с различными элементами, включая кислород, серу, халькогены и другие неинертные элементы. Это обуславливается особенностями их электронного строения, где на внешнем энергетическом уровне находятся несколько валентных электронов.
Взаимодействие переходных металлов с кислородом происходит путем образования оксидов. При этом переходные металлы могут образовывать соединения с различными степенями окисления, что позволяет им проявлять разнообразные химические свойства.
Серный атом в соединениях с переходными металлами может образовывать две или более координационные связи. Это позволяет переходным металлам образовывать различные комплексы с серой, например, сульфаты и сульфиды.
Кроме того, переходные металлы способны взаимодействовать с халькогенами (фтором, хлором, бромом, йодом), образуя халогениды. В некоторых случаях такие соединения могут обладать интересными свойствами, например, демонстрировать магнитное или ферроэлектрическое поведение.
Значение переходных металлов в различных отраслях

Переходные металлы играют важную роль в различных отраслях промышленности и науке. Благодаря своим уникальным свойствам, они широко применяются в металлургии, электротехнике, каталитической химии, медицине и других областях.
В металлургии переходные металлы используются для производства стали и различных сплавов. Их присутствие в сплавах позволяет улучшить механические свойства материалов, придать им прочность, твердость и устойчивость к коррозии. Кроме того, переходные металлы могут улучшить рабочие характеристики сплавов, такие как пластичность, ударная вязкость и теплопроводность.
В электротехнике переходные металлы применяются для создания проводников, контактов и электродов благодаря своей высокой электропроводности. Они также используются в производстве магнитов и суперпроводников, что находит применение в современных технологиях энергетики и магнитных системах.
Каталитическая химия является одной из важных областей применения переходных металлов. Они играют роль катализаторов, т.е. повышают скорость химических реакций без участия самих веществ. Переходные металлы могут быть использованы в различных каталитических процессах, таких как окисление, гидрогенирование и синтез органических соединений.
В медицине переходные металлы имеют широкий спектр применений. Они используются в качестве компонентов лекарственных препаратов и добавок к пище. Некоторые переходные металлы обладают антиоксидантными свойствами и способны защищать организм от воздействия свободных радикалов. Кроме того, переходные металлы обладают антибактериальными свойствами и используются в медицинских инструментах и имплантатах.
Выведенная таблица представляет значение нескольких переходных металлов в различных отраслях:
| Металл | Металлургия | Электротехника | Каталитическая химия | Медицина |
|---|---|---|---|---|
| Железо | Изготовление стали | Магниты, проводники | Синтез органических соединений | Препараты, добавки к пище |
| Медь | Электротехника | Проводники, контакты | Окисление | Антиоксиданты |
| Платина | Катализаторы | Магнитные системы | Гидрогенирование | Медицинские инструменты, имплантаты |
Вопрос-ответ

Какие элементы относятся к переходным металлам?
К переходным металлам относятся элементы, которые находятся в середине периодической системы. Некоторые из них: железо, медь, никель, цинк и другие.
Чем отличаются переходные металлы от благородных металлов?
Переходные металлы имеют неполностью заполненные внутренние электронные оболочки, что позволяет им образовывать разнообразные ионы с различными степенями окисления. Благородные металлы же имеют полностью заполненные s- и p-оболочки и образуют ионы с постоянной степенью окисления.
Какие свойства переходных металлов связаны с их электронной структурой?
Свойства переходных металлов, такие как высокая тепло- и электропроводность, а также способность образовывать соединения с различной степенью окисления, связаны с их электронной структурой. Неполностью заполненные d-оболочки позволяют переходным металлам образовывать сложные координационные соединения и принимать участие в различных каталитических реакциях.
Какова роль переходных металлов в живых организмах?
Переходные металлы играют важную роль в живых организмах. Например, железо является необходимым компонентом гемоглобина, который отвечает за перенос кислорода в крови. Кобальт входит в состав витамина В12, который необходим для нормального функционирования нервной системы. Многие другие переходные металлы также являются важными элементами для жизнедеятельности организмов.
Как можно объяснить различие в химических свойствах разных переходных металлов?
Различие в химических свойствах разных переходных металлов объясняется различием в их электронной структуре. Количество внешних электронов и их распределение по энергетическим уровням влияют на способность образования соединений и степень окисления, что определяет химическую активность каждого металла.
