Переходные металлы – это группа химических элементов в периодической таблице, которые находятся между главными группами: 2 и 13, 3 и 14, 4 и 15, 5 и 16, 6 и 17, 7 и 18. Всего в этой группе находятся 38 элементов, начиная с скандия и заканчивая лаврецием. Они также известны как d-элементы, так как все они имеют заполненную электронную оболочку d-орбиталями.
Особенностью переходных металлов является их способность образовывать ионы различной степени окисления. Это связано с наличием неполностью заполненного внешнего энергетического уровня, на котором располагаются d-электроны. Благодаря этому переходные металлы способны образовывать сложные соединения и проявлять различные химические свойства.
Переходные металлы широко применяются в различных областях науки, техники и промышленности. Например, они используются в качестве катализаторов в химических реакциях, а также для создания сплавов с другими металлами, чтобы улучшить их свойства. Переходные металлы также находят применение в производстве электроники, аккумуляторов, керамики и многих других материалов.
Изучение переходных металлов имеет важное значение для развития химии и создания новых материалов с улучшенными свойствами. Понимание их структуры, свойств и химического поведения позволяют улучшить технологические процессы и создать новые материалы с нужными свойствами.
Таким образом, переходные металлы являются важной группой элементов, которые обладают уникальными свойствами и находят широкое применение в науке и промышленности. Изучение их химических свойств и особенностей помогает улучшить технологические процессы и создать новые материалы, которые в свою очередь могут применяться в различных областях человеческой деятельности.
Переходные металлы: классификация и химические свойства
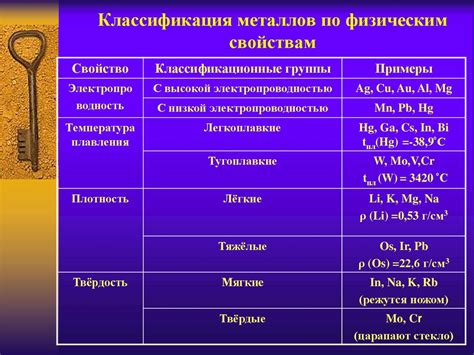
Переходные металлы – это элементы, которые расположены в середине периодической системы элементов между металлами главной подгруппы и благородными газами. Основное свойство переходных металлов – наличие неполной d-оболочки электронов.
К переходным металлам относятся такие элементы, как титан, ванадий, хром, марганец, железо, никель, медь, цинк, рутений, родий, платина и другие. Эти металлы имеют различные химические свойства и широко используются в различных отраслях промышленности.
Одним из главных химических свойств переходных металлов является способность образовывать соединения с разными степенями окисления. Это означает, что переходные металлы могут образовывать различные ионы, меняя число и положение электронов в своей d-оболочке.
Кроме того, переходные металлы обладают высокой каталитической активностью. Они способны активировать реакции, ускоряя их протекание. Именно благодаря этому свойству переходные металлы широко используются в катализаторах различного назначения в промышленности и синтезе органических соединений.
Также стоит отметить, что переходные металлы характеризуются высокой термостойкостью и прочностью. Это делает их идеальными материалами для изготовления различных конструкционных элементов, авиационных и космических компонентов, судостроительных и машиностроительных частей.
Классификация переходных металлов по Менделееву
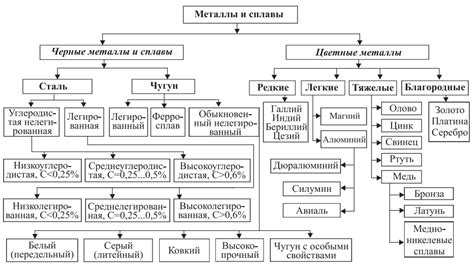
Переходными металлами являются элементы из d-блока периодической системы, находящиеся между блоками s и p. Всего в d-блоке находится 10 переходных металлов.
Менделеев разделил переходные металлы на две основные группы: первый и второй переходные ряды. Первый переходной ряд включает элементы черного железа (Fe), хрома (Cr) и марганца (Mn), а также другие элементы до никеля (Ni). Второй переходной ряд начинается с меди (Cu) и включает элементы до цинка (Zn). В каждом переходном ряду есть особенности, которые определяют их свойства и химическую реактивность.
Переходные металлы обладают рядом общих свойств, таких как высокая термическая и электропроводность, способность образовывать соединения с различными степенями окисления и образование комплексных соединений. Одной из особенностей переходных металлов является их способность образовывать большое количество стабильных соединений, что делает их важными компонентами в различных промышленных процессах и природных системах.
Классификация переходных металлов по Менделееву позволяет систематизировать эти элементы и лучше понять их химические свойства и взаимодействия. Эта классификация является важным инструментом в научных исследованиях и применяется в различных областях, включая химию, физику и материаловедение.
Химические свойства переходных металлов

Переходные металлы отличаются широким спектром химических свойств, что делает их особенно важными в химии и промышленности. Вот несколько основных химических свойств переходных металлов:
- Высокая реакционная способность: Переходные металлы способны образовывать соединения с различными элементами, такими как кислород, сера, азот и другие. Они могут образовывать различные степени окисления, что значительно расширяет возможности их химических взаимодействий.
- Образование комплексных соединений: Переходные металлы могут образовывать комплексы с различными лигандами, такими как аммиак, вода, хлориды и другими органическими и неорганическими соединениями. Это обусловлено их способностью образовывать связи с различными электронными конфигурациями и структурами.
- Катализаторы: Многие переходные металлы являются эффективными катализаторами химических реакций. Они могут изменять скорость и направление реакции, повышать эффективность процессов и обеспечивать высокую селективность при синтезе органических соединений.
- Цветные соединения: Многие переходные металлы образуют цветные соединения. Это связано с тем, что они поглощают свет определенных длин волн и испускают другой, что приводит к появлению цвета. Для примера можно привести цветные соединения меди, железа, хрома и других переходных металлов.
- Магнитные свойства: Некоторые переходные металлы обладают магнитными свойствами, что делает их полезными для создания магнитов и приборов на основе электромагнетизма. Например, железо, никель и кобальт являются ферромагнетиками и обладают высокой намагниченностью.
- Вариабельность валентности: Переходные металлы могут принимать различные степени окисления в своих соединениях, что дает возможность для образования различных типов соединений и сильно варьирующегося химического поведения.
Все эти химические свойства делают переходные металлы важными элементами для различных областей науки и технологии, от промышленности до биологии и медицины.
Вопрос-ответ

Какие элементы относятся к переходным металлам?
К переходным металлам относятся элементы, которые находятся в блоке d периодической системы. Это включает в себя такие элементы, как железо, медь, цинк, никель и титан.
Какой химический признак имеют переходные металлы?
Основным химическим признаком переходных металлов является возможность образования ионов разных степеней окисления. Они также обладают высокой электропроводностью и формируют разнообразные соединения с другими элементами.
Какова роль переходных металлов в химических реакциях?
Переходные металлы играют важную роль в химических реакциях. Они могут служить катализаторами, ускоряя химические процессы. Они также образуют стабильные комплексные соединения и могут вступать в реакции с различными веществами, включая кислород, серу и азот.
Каковы основные свойства переходных металлов?
Основные свойства переходных металлов включают высокую плотность, тугоплавкость, твердость и химическую инертность. Они также хорошо проводят тепло и электроэнергию. Многие переходные металлы имеют яркие цвета, что делает их полезными в производстве красок и пигментов.
Какую роль переходные металлы играют в живых организмах?
Переходные металлы играют важную роль в живых организмах. Например, железо является необходимым для образования гемоглобина, который переносит кислород в крови. Многие другие переходные металлы также участвуют в различных биологических процессах, таких как ферментационная активность и регулирование уровня химического баланса в организме.
