Щелочи металлов – это химические соединения, образующие сильно щелочные растворы в воде. Они обладают рядом характерных свойств, которые отличают их от других классов химических соединений.
Во-первых, щелочи металлов характеризуются высокими значениями pH, что свидетельствует о их сильно щелочной природе. Они образуют растворы, имеющие значение pH больше 7. Вода при реакции с щелочью металла образует металлическое гидроксидное соединение, которое имеет щелочные свойства.
Во-вторых, щелочи металлов обладают амфотерными свойствами. Это значит, что они могут реагировать как с кислотами, так и с основаниями. Эта способность позволяет им широко применяться в различных химических реакциях, включая нейтрализацию кислот и образование химических осадков.
В-третьих, щелочи металлов образуют растворимые гидроксиды, которые являются основными компонентами щелочных растворов. Они хорошо растворимы в воде и образуют густые, прозрачные растворы с высоким содержанием гидроксидов металлов.
Важно отметить, что щелочи металлов имеют широкое применение в промышленности, в том числе в производстве стекла, мыла, моющих средств и других химических продуктов. Они также используются в лабораторных условиях для настройки pH растворов и проведения химических экспериментов.
В заключение, щелочи металлов – это важный класс химических соединений с высокими щелочными свойствами. Они являются основой для многих промышленных и лабораторных процессов, а также играют значимую роль в химической науке и технологии.
Перечень щелочных металлов
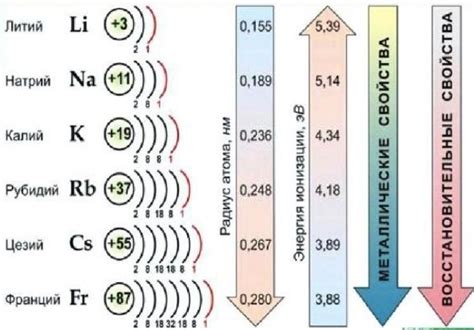
Щелочные металлы – это элементы, которые относятся к первой группе периодической системы химических элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы характеризуются преобладанием щелочных оксидов и гидроксидов в их соединениях и имеют определенные общие свойства.
Литий (Li) – легкий металл, химический элемент первой группы периодической системы. Он используется в производстве легких конструкций, литий-ионных аккумуляторов, а также в некоторых фармацевтических препаратах.
Натрий (Na) – металл, ярко-желтый элемент первой группы периодической системы. Он широко используется в промышленности для производства щелочей, стекла и мыла. Также натрий является важным элементом в биологических системах организмов.
Калий (K) – мягкий серебристо-белый металл, который входит в состав многих минералов и органических соединений. Калий используется в сельском хозяйстве в виде удобрений, а также в медицине и в производстве стекла.
Рубидий (Rb) – прочный мягкий серебристо-белый металл, который имеет схожие свойства с калием. Рубидий используется в научных исследованиях, в часах с атомным временем и в оптических приборах.
Цезий (Cs) – мягкий золотисто-желтый химический элемент, который имеет схожие свойства с другими щелочными металлами. Цезий используется в некоторых электронных приборах и в научных исследованиях.
Франций (Fr) – редкий радиоактивный химический элемент, который имеет крайне короткий срок полураспада. В связи с этим его свойства и применение слабо изучены.
Описание свойств металлов первой группы

Металлы первой группы периодической системы могут быть отнесены к щелочным металлам и включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов имеются ряд особенных химических свойств, которые делают их уникальными.
Во-первых, металлы первой группы обладают высокой химической реактивностью. Они способны активно взаимодействовать с кислородом, водой, некоторыми галогенами и другими веществами. Например, при контакте с водой они мгновенно реагируют, образуя щелочную среду и выделяя водород. Такие реакции часто сопровождаются выделением тепла.
Во-вторых, металлы первой группы хорошо растворяются в воде и образуют щелочные растворы. Растворы этих металлов обладают характерными свойствами, такими как щелочная реакция, способность нейтрализовать кислоты и образование осадков при взаимодействии с некоторыми солями.
В-третьих, металлы первой группы обладают свойством образовывать ионы с однозначным положительным зарядом, так называемые щелочные ионы. Это делает их активными ионами, способными принимать участие в реакциях обмена, образованию сложных соединений и обмену протонами с другими веществами.
Наконец, металлы первой группы характеризуются низкой плотностью, низкой температурой плавления и небольшой твердостью. Они обычно выглядят как мягкие металлические элементы, легко режутся ножом и обладают хорошей пластичностью.
В целом, металлы первой группы обладают рядом особых химических свойств, которые делают их важными компонентами во многих процессах и приложениях. Их уникальные свойства широко используются в различных отраслях науки и техники.
Химические свойства щелочных металлов:
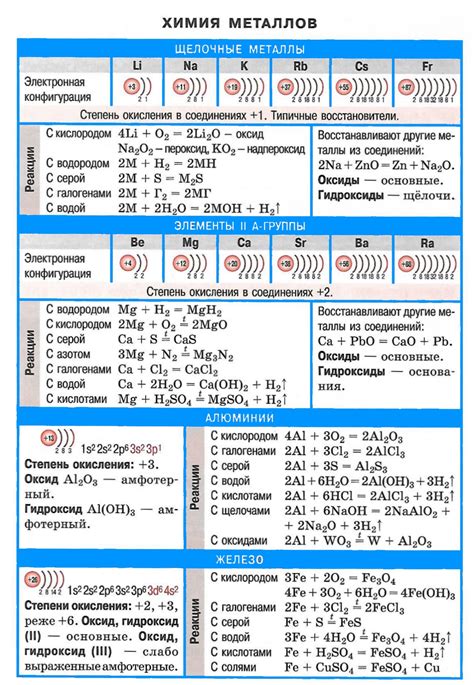
1. Реакция с водой: Щелочные металлы легко реагируют с водой, образуя гидроксиды и выделяя водород. Реакция протекает очень быстро и сопровождается выделением тепла. Цезий и франций являются самыми реактивными щелочными металлами, а литий - наименее реактивным.
2. Реакция с кислородом: Щелочные металлы активно реагируют с кислородом воздуха, образуя оксиды. Например, натрий образует оксид натрия (Na2O), который обладает щелочными свойствами. Калий реагирует с кислородом, образуя оксид калия (K2O), который также является щелочным.
3. Реакция с кислотами: Щелочные металлы активно реагируют с кислотами, образуя соли и выделяя водород. Например, реакция натрия с соляной кислотой протекает следующим образом: 2Na + 2HCl -> 2NaCl + H2.
4. Реакция с неметаллами: Щелочные металлы реагируют с неметаллами, образуя соли. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl), который является нерастворимым в воде и является одним из наиболее известных солей.
5. Взаимодействие с аммиаком: Щелочные металлы реагируют с аммиаком (NH3), образуя комплексные соединения, известные как аммиакаты. Например, натрий формирует аммиакат натрия (NaNH3), который является стабильным и широко используется в химической промышленности.
Химические свойства щелочных металлов обусловлены их электрохимической активностью, способностью образовывать ионные связи и ионные соединения с другими элементами и соединениями. Эти свойства делают щелочные металлы важными реагентами в различных химических процессах и широко используемыми в промышленности и научных исследованиях.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций.
Каковы основные химические свойства щелочей металлов?
Основные химические свойства щелочей металлов включают высокую реакционную способность, образование гидроксидов при реакции с водой, образование солей с кислотами, образование металлических оксидов при сгорании и образование гидридов при реакции с водородом.
Каковы особенности реакции щелочей металлов с водой?
Реакция щелочей металлов с водой приводит к образованию гидроксидов и выделению водорода. Реакция характеризуется высокой реакционной способностью и сильным образованием щелочей. Также важным результатом реакции является появление щелочных растворов.
