Щелочные металлы – это группа элементов периодической системы, расположенных в первой группе. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы являются химически активными элементами, имеющими одну валентную электрону во внешней оболочке. Они обладают низкой плотностью, низкой температурой плавления и кипения, а также мягкостью и низкой твердостью.
Одной из главных характеристик щелочных металлов является их реактивность. Они легко реагируют с водой, выделяясь водородом и образуя основания. Также они образуют соли с кислотами, что делает их важными реагентами в химической промышленности.
Каждый элемент группы щелочных металлов имеет свои уникальные свойства и химические реакции. Литий используется в различных электронных устройствах, натрий в пищевой промышленности, а калий является необходимым микроэлементом для живых организмов. Рубидий, цезий и франций встречаются в редких минералах и используются в научных исследованиях и технологиях.
Перечень щелочных металлов
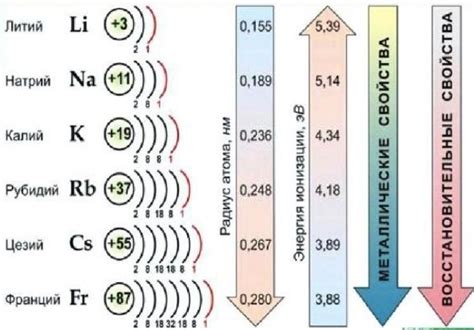
Щелочные металлы - это элементы химической группы I периодической системы элементов. Они являются самыми активными металлами и обладают рядом характерных свойств.
Перечень щелочных металлов включает:
- Литий (Li) - элемент с атомным номером 3. Он является легким и мягким металлом, обладает высокой реактивностью.
- Натрий (Na) - элемент с атомным номером 11. Обычно встречается в виде солей и ионов в природе.
- Калий (K) - элемент с атомным номером 19. Является важным питательным элементом для живых организмов.
- Рубидий (Rb) - элемент с атомным номером 37. Имеет сходные свойства с калием и натрием.
- Цезий (Cs) - элемент с атомным номером 55. Это самый реактивный щелочной металл.
- Франций (Fr) - элемент с атомным номером 87. Является самым редким и наиболее радиоактивным щелочным металлом.
Щелочные металлы обладают низкими температурами плавления и кипения, высокой электропроводностью и способностью образовывать оксиды и гидроксиды. Они широко используются в промышленности, медицине и других областях науки и техники.
Литий, натрий, калий

Щелочные металлы - это группа химических элементов, которые принадлежат первой группе периодической системы. Они включают в себя три основных элемента: литий, натрий и калий.
Литий (Li) - легкий металл с атомным номером 3 и атомной массой 6,94. Он обладает низкой плотностью и высокой химической реактивностью. Литий является одним из наиболее реактивных металлов и широко используется в производстве аккумуляторов, легких сплавов и лекарств.
Натрий (Na) - металл с атомным номером 11 и атомной массой 22,99. Он обладает серебристым блеском и высокой реактивностью. Натрий широко используется в производстве пищевых добавок, стекла и металлических сплавов. Он также является важным элементом для поддержания нормального функционирования организма человека.
Калий (K) - химический элемент с атомным номером 19 и атомной массой 39,10. Он является мягким серебристо-белым металлом. Калий широко используется в сельском хозяйстве, где его соединения применяются как удобрения для повышения плодородия почвы. Он также играет важную роль в нормализации водно-солевого баланса организма.
Рубидий, цезий и франций

Рубидий (Rb) – один из щелочных металлов, который находится в основной группе периодической системы химических элементов. Рубидий обладает слабыми ковылечивыми свойствами, что делает его мягким и легким металлом. Он является серебристо-белого цвета и имеет низкую плотность. Рубидий активно реагирует с водой и воздухом, образуя соответствующие оксиды и гидроксиды.
Цезий (Cs) – еще один щелочной металл, который также относится к основной группе периодической системы. Цезий имеет характерные физические свойства, например, он является мягким и довольно плотным металлом. Цезий имеет низкую плотность и плавится при относительно низкой температуре. Он активно реагирует с водой, выделяя газообразный водород.
Франций (Fr) – самый редкий и радиоактивный щелочный металл. Он является последним элементом основной группы периодической системы. Франций очень нестабилен и быстро распадается, образуя другие элементы. В природе встречается лишь в очень малых количествах, поэтому его изучение сложно. Франций был именован в честь Франции, в честь которой названный щелочный металл.
Активность и реактивность

Активность щелочных металлов определяется их способностью вступать в химические реакции с другими веществами. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью. Они могут вступать в реакции с водой, кислородом, аммиаком и другими веществами, образуя соединения различной природы.
Высокая активность щелочных металлов обусловлена их низкой ионизационной энергией и большой химической реакционной способностью. Они легко отдают свой внешний электрон, образуя положительный ион, что делает их очень реактивными веществами.
Самым активным щелочным металлом является цезий. Он реагирует с воздухом, водой и большинством других элементов. Реакция цезия с водой является наиболее яркой и впечатляющей. При контакте с водой цезий выделяет водород и образует гидроксид цезия, сопровождаясь высвобождением большого количества тепла и возгоранием.
Реактивность щелочных металлов также растёт в таблице Менделеева по мере увеличения атомного номера. Это связано с увеличением размера ионов и слабыми связями с внешними электронами. Однако, активность растет нелинейно, так как вносит существенное влияние ионизационная энергия, которая увеличивается при движении вниз по группе.
Физические свойства щелочных металлов

Щелочные металлы - это металлы, относящиеся к первой группе периодической таблицы элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть ряд характерных физических свойств, которые делают их особенными и полезными.
1. Атомный радиус: Атомы щелочных металлов имеют большие размеры. Из них самым маленьким является литий, а самым большим - цезий. Это связано с тем, что внешний электронный слой у щелочных металлов состоит из одного электрона, что позволяет атомам сильно искажаться и создавать большие размеры.
2. Плотность: Щелочные металлы обладают низкой плотностью, что делает их легкими и подвижными веществами. Наиболее плотным из них является литий (0,53 г/см³), а наименее плотным - цезий (1,87 г/см³).
3. Температура плавления и кипения: У щелочных металлов низкие значения температуры плавления и кипения, что связано с низкой силой межатомных связей. Например, температура плавления лития составляет около 180°C, а цезия - около 28°C.
4. Электропроводность: Щелочные металлы обладают высокой электропроводностью. Их атомы имеют один валентный электрон, который легко двигается в электрическом поле. Благодаря этому, щелочные металлы в основном используются в проводниковых материалах и батареях.
5. Отталкивание от воды: Щелочные металлы, включая натрий, калий и литий, реагируют с водой, образуя гидроксиды и выделяя водород. Это происходит из-за высокой реакционной активности металлов и их низкой энергии ионизации.
В целом, физические свойства щелочных металлов являются основой для их широкого использования в различных областях, включая промышленность, электронику и медицину.
Химические свойства щелочных металлов

Щелочные металлы являются самой реактивной группой элементов в периодической таблице. Они обладают высокой реактивностью из-за своей низкой электроотрицательности и готовности отдавать электроны при взаимодействии с другими веществами.
Щелочные металлы легко реагируют с кислородом, взрываясь воздухом или горя. При контакте с водой они образуют щелочные растворы, выделяясь водород. Щелочные металлы могут реагировать с множеством других элементов, образуя соединения, такие как оксиды, соли и гидриды.
Коммерческая важность щелочных металлов обусловлена их способностью образовывать щелочные гидроксиды, которые широко используются в промышленности, например, в производстве мыла, стекла и моющих средств. Они также используются в батареях, горючей порошковой смеси и в других важных технологиях.
Щелочные металлы хорошо ионизируются при потере электрона, образуя положительно заряженные катионы. Это делает их полезными при создании батарей и аккумуляторов, где они используются в качестве отрицательных электродов или анодов.
Один из основных недостатков работы с щелочными металлами заключается в их высокой реактивности и способности накапливать влагу. Они должны храниться под слоем минерального масла или в сухих условиях, так как даже капля влаги может вызвать взрыв.
Кроме того, щелочные металлы обладают высокой электроотрицательностью, что значит, что они способны разрушать множество органических веществ, в том числе кожу и ткани. По этой причине они требуют особой осторожности при обращении и хранении.
Взаимодействие щелочных металлов с водой

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и прочие, проявляют активное взаимодействие с водой. Это связано с их химической природой и электрохимическими свойствами.
При контакте щелочные металлы с водой происходит сильное окислительное действие. В результате этого взаимодействия образуется щелочное гидроксидное соединение и выделяется водород.
Процесс реакции щелочных металлов с водой проходит достаточно быстро и сопровождается выделением тепла. Например, литий при контакте с водой превращается в гидроксид лития, образуется водород и выделяется энергия.
Взаимодействие щелочных металлов с водой можно описать следующей химической реакцией: M + H2O → M(OH) + 1/2H2, где M обозначает щелочный металл.
Важно отметить, что различные щелочные металлы проявляют разную активность при взаимодействии с водой. Например, калий реагирует более интенсивно и быстро, чем литий.
Использование щелочных металлов

Полезные свойства щелочных металлов делают их широко используемыми в различных отраслях промышленности и науки. Натрий, калий и другие металлы этой группы играют важную роль в жизни человечества.
Применение в электротехнике: литий и калий используются в производстве аккумуляторных батарей, которые находят широкое применение в мобильных устройствах, электроавтомобилях и других энергоемких устройствах. Калий также используется в изготовлении стекла для плоскопечатных телевизоров.
Применение в легкой промышленности: натрий используется в производстве мыла, стекла и щелочей. Литий используется в производстве легких сплавов, которые используются в авиационной и автомобильной промышленности для снижения веса изделий.
Применение в медицине: литий используется в лекарственных препаратах для лечения биполярного расстройства и предотвращения эпизодов депрессии. Калий используется в медицине для поддержания нормального уровня электролитов в организме.
Применение в сельском хозяйстве: натрий и калий являются основными компонентами удобрений для растений. Они необходимы для нормального роста и развития растений, а также для регулирования их водного баланса.
Применение в научных исследованиях: щелочные металлы широко используются в химических, физических и биологических исследованиях. Натрий и калий часто используются в лабораторных условиях для проведения различных экспериментов и анализов.
Важность щелочных металлов в жизни

Щелочные металлы играют важнейшую роль в жизни как растений, так и животных, а также в функционировании нашего организма. Эти элементы обладают уникальными свойствами, которые используются в различных областях науки и промышленности.
Во-первых, щелочные металлы имеют высокую реактивность и способность образовывать ионы с положительным зарядом. Именно благодаря этим свойствам они играют важную роль в клеточном метаболизме организмов. Калий и натрий, например, участвуют в передаче нервного импульса и контроле работы мышц. Калий также регулирует уровень жидкости в организме и поддерживает нормальное кровяное давление.
Во-вторых, щелочные металлы используются в различных областях промышленности. Натрий является основным компонентом пищевой соли и применяется в пищевой, химической и стекольной промышленности. Литий используется в производстве литий-ионных аккумуляторов, которые широко применяются в электронике. Калий применяется в производстве удобрений и стекла, а также используется в промышленности бумаги и мыла.
В-третьих, щелочные металлы являются необходимыми элементами для растений. Калий, натрий и литий входят в состав многих ферментов и участвуют в регуляции физиологических процессов растений. Они необходимы для роста и развития растений, образования и транспорта питательных веществ.
Таким образом, щелочные металлы играют незаменимую роль в жизни, оказывая влияние на клеточный метаболизм организмов, используясь в промышленности и необходимые для роста и развития растений. Изучение этих элементов и использование их свойств в различных областях науки и промышленности способствует развитию и прогрессу человечества.
Вопрос-ответ

Какие элементы входят в группу щелочных металлов?
К группе щелочных металлов относятся следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают рядом характерных свойств: они очень реактивны, легко окисляются при контакте с воздухом, имеют низкую плотность, низкую температуру плавления и кипения, образуют ионы с положительным зарядом.
Для чего используются щелочные металлы?
Щелочные металлы находят широкое применение в различных областях. Например, натрий используется в пищевой промышленности для соления и консервирования пищевых продуктов, а также в производстве стекла и мыла. Калий используется в удобрениях для повышения плодородия почвы. Литий находит применение в производстве аккумуляторов и лекарственных препаратов. Рубидий используется в научных исследованиях и в некоторых электронных устройствах. В целом, щелочные металлы играют важную роль в различных промышленных и научных процессах.
