Марганец является химическим элементом с атомным номером 25 и обозначением Mn в таблице Mendeleev. Этот металл характеризуется высокой химической активностью и может образовывать различные соединения со многими элементами. Одним из таких соединений является оксид марганца (MnO2), который получают путем химической реакции между марганцем и углекислым газом (CO2).
Уравнение реакции может быть записано следующим образом:
Mn + CO2 → MnO2
Эта реакция является окислительно-восстановительной, где марганец Mn окисляется из исходного состояния катиона Mn2+ до более высокого окисления, формируя оксид марганца MnO2. Углекислый газ (CO2) в данной реакции выступает в роли восстановителя, тогда как марганец является окислителем.
Получение металла MnO2 из Mn и CO2 является важным процессом в химической промышленности. MnO2 используется в различных отраслях, включая электрохимию, косметическую и фармацевтическую промышленность. Эта реакция также может иметь место в естественных условиях, например при окислении руды марганца в стратифицированных рудниках.
Роль металла MnO2 в химической реакции

Металл MnO2 играет важную роль в химической реакции, которая осуществляется для получения данного соединения из металла Mn и CO2.
Во-первых, металл MnO2 выполняет функцию катализатора, активируя процесс реакции. Катализаторы способствуют ускорению химических реакций, позволяя снизить температуру и давление, которые необходимы для проведения реакции.
Во-вторых, MnO2 участвует в самой реакции, переходя из первоначального состояния в окисленное и после реакции вновь возвращается в исходное состояние.
Реакция получения металла MnO2 из Mn и CO2 является окислительно-восстановительной реакцией. Металл Mn при контакте с CO2 окисляется до состояния MnO2.
Таким образом, металл MnO2 играет не только катализаторную роль, но и является непосредственным участником реакции, в которой происходит преобразование исходных веществ.
Процесс получения металла MnO2

Металл MnO2 можно получить путем химической реакции, в которой в качестве исходного вещества используется металл Mn и CO2.
Первоначально, металл Mn подвергается воздействию углекислого газа CO2. В результате этой реакции образуется металлокарбонат MnCO3 и выделяется углекислый газ. Однако, для получения искомого металла MnO2, необходимо провести дополнительные шаги.
Далее, металлокарбонат MnCO3 подвергается обработке сильными окислителями, например, хлорном или перманганатном калием KMnO4. В результате этой реакции происходит окисление металлокарбоната до металла оксида MnO2. Окислитель, в свою очередь, претерпевает снижение степени окисления.
Полученный металл MnO2 обладает высокой степенью чистоты и используется в различных областях промышленности и науки. Этот материал широко применяется в электрохимических системах, сплавах, катализаторах и других технологических процессах.
Реакция окисления

Реакция окисления представляет собой химическую реакцию, при которой одно вещество отдает электроны, а другое вещество принимает их. Окисление является одной из основных реакций, происходящих в химических процессах.
В реакции окисления важную роль играют вещества, называемые окислителями. Окислители обладают высокой электроотрицательностью и удерживают электроны, полученные от окисляемого вещества. Наоборот, окисляемое вещество отдает электроны и превращается в ион или соединение с меньшей степенью окисления. Таким образом, реакция окисления приводит к изменению степени окисления атомов веществ.
Реакция окисления может проходить как в присутствии кислорода, так и без него. При окислении с участием кислорода происходит образование оксида, в то время как без кислорода окисление может происходить посредством взаимодействия с другими веществами. Реакция окисления имеет большое значение во многих процессах, включая реакции сгорания, протекающие в организмах или промышленности.
Примером реакции окисления может служить получение металла MnO2 из металла Mn и газообразного вещества CO2. При этом происходит окисление металла Mn и превращение его в оксид MnO2, а CO2 выступает в роли окислителя, принимая электроны от окисляемого вещества.
Использование MnO2 в промышленности

Металлический оксид марганца (MnO2) имеет широкий спектр применения в различных отраслях промышленности. Его высокая химическая активность и устойчивость к воздействию окружающей среды делают его ценным материалом для многих процессов и технологий.
В производстве батарей MnO2 широко используется в качестве активного компонента для катодов. Он отличается высокой электрохимической активностью и способен обеспечить длительное и стабильное электрохимическое действие.
Также MnO2 находит применение в процессах водоочистки. Благодаря своей окислительной активности, он способен удалять различные загрязнения из водных растворов, включая органические вещества, тяжелые металлы и другие примеси. Это делает его важным компонентом в системах очистки воды для промышленных предприятий и коммунального хозяйства.
Еще одно применение MnO2 - это производство стекла и керамики. Он используется в качестве пигмента для придания желтого или коричневого цвета продуктам, а также в качестве добавки для усиления структурных свойств материалов.
MnO2 также используется в электрохимическом производстве водорода и водородных топливных элементов. Он служит катализатором для реакции окисления воды и способствует получению высокой электрохимической активности, необходимой для эффективного производства энергии.
В итоге можно сказать, что MnO2 играет важную роль в современной промышленности благодаря своим уникальным свойствам и широкому спектру применения. Его использование в различных процессах и технологиях является неотъемлемым элементом многих производств и способствует развитию инноваций в различных отраслях.
Химические свойства MnO2

MnO2 (диоксид марганца) - это химическое соединение, имеющее некоторые интересные свойства и широко используемое в различных отраслях промышленности.
Окислительные свойства: MnO2 является сильным окислителем, способным передавать кислородные атомы в реакциях окисления. Это свойство делает его полезным ингредиентом во многих катализаторах, используемых в органическом синтезе.
Химическая стабильность: MnO2 обладает высокой химической стабильностью и инертностью, что делает его полезным в различных приложениях, включая производство батарей и гальванических элементов.
Адсорбционные свойства: Многие соединения марганца, включая MnO2, обладают высокими адсорбционными свойствами и могут использоваться в процессах очистки воды и удаления загрязнений из промышленных сточных вод.
Электродные свойства: MnO2 может служить как активный материал в электронных компонентах, таких как конденсаторы и суперконденсаторы, благодаря своей способности эффективно сопротивлять электрическому току и иметь большую емкость.
Фармацевтическое применение: Некоторые формы марганца, включая MnO2, используются в медицине, особенно в витаминах и пищевых добавках, из-за их полезных свойств и способности улучшать здоровье.
В целом, MnO2 имеет широкий спектр химических свойств, делающих его полезным в различных сферах промышленности и научных исследований.
Реактивность MnO2
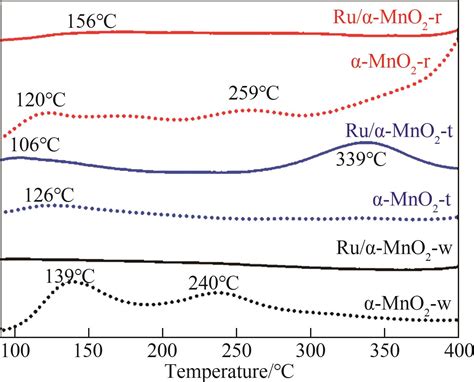
MnO2 - оксид марганца (IV), обладает высокой реактивностью и применяется в различных процессах и реакциях.
В химических реакциях MnO2 активно взаимодействует с другими веществами. Он является сильным окислителем, способным передавать свои электроны другим веществам. Благодаря этому он широко используется в процессах окисления, восстановления и катализа.
Одним из способов использования MnO2 является его применение в процессах удаления загрязнений и очистки воды. Благодаря своей высокой активности, он способен окислять различные вредные вещества, такие как органические соединения и тяжелые металлы, улучшая качество воды и делая ее безопасной для питья и использования в промышленности.
MnO2 также находит применение в электрохимических синтезах и батареях. В реакциях восстановления марганца (IV) оксид используется в качестве электродного материала, способного передавать и принимать электроны. Это позволяет использовать его в процессах зарядки и разрядки батарей, сохраняя и передавая электрическую энергию.
Кроме того, MnO2 может использоваться в качестве катализатора в различных химических реакциях. Он способствует ускорению реакций и снижению энергии активации благодаря своим уникальным свойствам поверхности. Это позволяет сэкономить время и энергию при проведении различных процессов, таких как синтез органических соединений или производство химических веществ.
Механизм образования MnO2
Образование металла MnO2 из Mn и CO2 происходит по нескольким стадиям.
В начале реакции металл Mn вступает в контакт с CO2, при этом происходит окисление металла и образование оксида марганца(II) – MnO.
Далее, при дальнейшем воздействии кислорода и воды оксид марганца(II) окисляется до оксида марганца(IV) – MnO2. Также данный процесс может происходить в присутствии катализаторов, которые ускоряют реакцию.
Механизм образования MnO2 может быть представлен следующим образом:
- Сначала металл Mn реагирует с CO2 и образуется оксид марганца(II) – MnO.
- Далее, под воздействием кислорода и воды, оксид марганца(II) окисляется до оксида марганца(IV) – MnO2.
Таким образом, механизм образования MnO2 из Mn и CO2 проходит в несколько этапов, включающих окисление металла и последующую реакцию с кислородом и водой.
Получение MnO2 из Mn и CO2

Для получения оксида марганца (IV), MnO2, может быть использована химическая реакция между металлом марганца (Mn) и углекислым газом (CO2). MnO2 является важным соединением марганца, которое применяется в различных областях науки и промышленности.
Процесс получения MnO2 начинается с реакции между металлическим марганцем (Mn) и углекислым газом (CO2). В результате этой реакции образуется оксид марганца (IV) и углеродный газ (CO). Реакция может быть представлена следующим уравнением:
Mn + CO2 → MnO2 + CO
В данной реакции марганец обладает окислительными свойствами, тогда как углекислый газ является восстановителем. В результате реакции происходит окисление марганца и одновременное восстановление углекислого газа, что приводит к образованию оксида марганца (IV).
Оксид марганца (IV), MnO2, часто используется в производстве батареек и аккумуляторов, а также в процессах катализа и пигментации. Его свойства делают его полезным во многих областях, от электроники до медицины.
Вопрос-ответ

Какие вещества участвуют в реакции получения металла MnO2 из Mn и CO2?
В реакции получения металла MnO2 из Mn и CO2 участвуют следующие вещества: металл Mn (марганец), углекислый газ CO2 и металлоксид MnO2.
Каковы условия проведения реакции получения металла MnO2 из Mn и CO2?
Реакция получения металла MnO2 из Mn и CO2 проводится при нагревании смеси металла Mn и CO2 до определенной температуры. Точные условия зависят от конкретного эксперимента и должны быть прописаны в протоколе проведения.
Каково значение получения металла MnO2 из Mn и CO2?
Получение металла MnO2 из Mn и CO2 имеет большое значение в химической промышленности и научных исследованиях. Металл MnO2 широко используется в производстве батареек, керамики, стекла и других материалов. Также этот процесс имеет научный интерес для изучения свойств и взаимодействия различных химических элементов.
