Хроматоровидная кислота (Cr2O3) является важным соединением хрома, которое широко используется в различных отраслях промышленности. Получение этого соединения возможно через химическую реакцию, в которой взаимодействуют водород и соединение хрома.
Уравнение данной реакции может быть представлено следующим образом:
3H2 + 2Cr → Cr2O3 + 3H2O
В ходе этой реакции 3 молекулы водорода взаимодействуют с 2 молекулами хрома, образуя хроматоровидную кислоту (Cr2O3) и 3 молекулы воды (H2O).
Это уравнение является ключевым шагом в получении хроматоровидной кислоты, которая может быть использована в различных промышленных процессах, таких как производство красителей и пигментов, катализаторов и других химических соединений.
Реакция синтеза металла Cr2O3
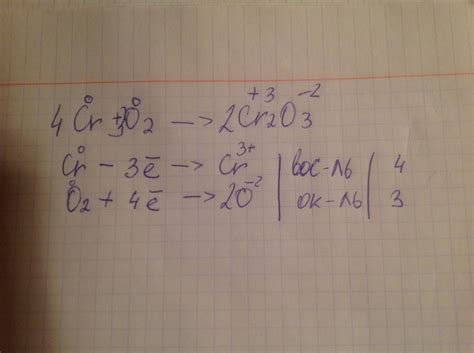
Реакция синтеза металла Cr2O3 является химической реакцией, в результате которой получается соединение крикальных оксидов металла с присутствием водорода. Данная реакция является очень важной, так как позволяет получить металл Cr, который обладает рядом полезных свойств и широко используется в различных отраслях промышленности.
Уравнение реакции синтеза металла Cr2O3 выглядит следующим образом:
- Cr2O3 + 3H2 → 2Cr + 3H2O
Синтез металла Cr2O3 осуществляется путем взаимодействия оксида хрома(III) с водородом при определенных условиях. Реакция протекает в присутствии катализатора и при высокой температуре. В результате реакции образуется металлический хром в виде порошка или гранул.
Металл Cr, полученный в результате синтеза Cr2O3, обладает высокой прочностью, твердостью и химической стойкостью. Он широко используется в производстве сплавов, металлических конструкций и различных изделий. Металл Cr также находит применение в электронике, химической промышленности и медицине.
Использование водорода в химической реакции

Водород – это элемент, который активно используется в различных химических реакциях. Он имеет много особенностей, которые делают его полезным и применимым в разных областях науки и промышленности.
Одной из главных областей использования водорода является химическая промышленность. Водород используется в качестве восстановителя, катализатора и ионной пары в различных процессах получения различных веществ и соединений.
Водород также используется в процессе получения металла Cr2O3. В этой химической реакции водород взаимодействует с окислителем Cr2O3, приводя к образованию металла Cr и воды. Для этого используется специальное оборудование и реакционные условия, чтобы обеспечить эффективность процесса и получение высококачественного продукта.
Водород также широко используется в промышленности для производства аммиака, водной паровой турбины, производства электролизного водорода, водородных топливных элементов и других приложений. Это связано с его высокими энергетическими свойствами и возможностью использования в качестве чистого и экологически чистого источника энергии.
Водород играет ключевую роль в различных процессах и является важным компонентом многих химических реакций. Благодаря своим уникальным свойствам водород активно применяется в различных отраслях науки и промышленности, способствуя развитию и улучшению процессов производства различных веществ и материалов.
Процесс получения металла Cr из Cr2O3

Металл хром (Cr) получают из оксида хрома(III) (Cr2O3) путем редукции. Этот процесс основан на химической реакции, в результате которой оксид хрома(III) превращается в металлический хром.
Для получения металла Cr из Cr2O3 можно использовать различные реагенты и методы редукции. Одним из наиболее распространенных методов является использование угарного кокса, который служит в качестве восстановителя.
Реакция редукции оксида хрома(III) с угарным коксом происходит при высокой температуре в специальных печах. Результатом этой реакции является образование металла хрома и выделение углекислого газа (CO2).
Важно отметить, что процесс получения металла Cr из Cr2O3 требует контроля за температурой, так как он происходит при высоких температурах, которые обеспечивают необходимую активность реагирующих частиц.
После получения металлического хрома его можно использовать в различных отраслях промышленности, включая производство сплавов, нержавеющих сталей, хромирование изделий и другие приложения.
Влияние реакции на окружающую среду

Химическая реакция получения металла Cr2O3 и водорода (H2) может оказывать некоторое влияние на окружающую среду. Рассмотрим основные аспекты данной реакции и ее последствия.
1. Выделение газов. В процессе реакции между оксидом хрома (Cr2O3) и водородом (H2) образуются два молекулы металла хрома (Cr) и три молекулы воды (H2O). Выделение молекул водорода и воды может привести к увеличению концентрации этих газов в окружающей атмосфере. Избыток этих газов может негативно сказаться на здоровье человека.
2. Использование химических веществ. Для проведения реакции требуется использование оксида хрома и водорода, которые являются химическими веществами. Изготовление и хранение этих веществ может требовать применение определенных процессов и оборудования, что может потребовать дополнительных энергетических и экологических затрат.
3. Отходы процесса. В конечном результате реакции образуются две молекулы металла хрома и три молекулы воды. Вода является натуральным и безопасным веществом, однако образование металлического хрома может создавать проблемы с его утилизацией или дальнейшей переработкой. Неконтролируемое обращение с отходами может оказать отрицательное воздействие на окружающую среду.
4. Энергетические затраты. В ходе проведения реакции требуется использование энергии для нагревания реагентов и поддержания оптимальных условий процесса. Такие энергетические затраты обычно ассоциируются с выбросами парниковых газов и негативно влияют на климат и экологическую ситуацию в целом.
Вывод: Химическая реакция получения металла Cr2O3 и водорода является сложным процессом, который может оказывать некоторое влияние на окружающую среду. Выделение газов, использование химических веществ и энергетические затраты могут иметь негативные последствия, если реакция не контролируется и не управляется соответствующим образом. Поэтому, при осуществлении данного процесса необходимо принимать меры для минимизации отрицательного воздействия на окружающую среду и применять эффективные технологии утилизации отходов.
Вопрос-ответ

Какое уравнение химической реакции соответствует получению металла Cr2O3, используя водород?
Уравнение химической реакции получения металла Cr2O3 с использованием водорода выглядит следующим образом:
Какие вещества участвуют в химической реакции получения металла Cr2O3?
В химической реакции получения металла Cr2O3 участвуют следующие вещества:
Какие продукты образуются при химической реакции получения металла Cr2O3 с использованием водорода?
При химической реакции получения металла Cr2O3 с использованием водорода образуются следующие продукты:
