Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., известны своей высокой активностью и реакционной способностью. Однако, с растворами солей они в большинстве случаев не взаимодействуют. За этим феноменом скрываются несколько причин, которые объясняют, почему щелочные металлы не проявляют реактивность в отношении солей.
Во-первых, щелочные металлы обладают высокой энергией ионизации, что делает их стабильными и малореактивными по отношению к растворам солей. Энергия ионизации – это энергия, необходимая для удаления одного электрона из атома металла. Щелочные металлы имеют низкую энергию ионизации, поэтому они легко отдают свой электрон, но они также имеют высокую энергию ионизации по сравнению с атомами, находящимися в растворах солей, что делает процесс реакции неспецифическим и трудным.
Во-вторых, щелочные металлы образуют инертные оксиды или гидроксиды, которые обладают стабильной структурой. Это означает, что они не проявляют химических свойств и не реагируют с другими веществами, в том числе с растворами солей. Такие оксиды или гидроксиды существуют в виде нежелательных отходов при реакции щелочных металлов с водой или кислотами и могут распадаться на ионы, которые становятся неактивными и не реагируют с солями.
Таким образом, причины, по которым щелочные металлы не реагируют с растворами солей, связаны с их высокой энергией ионизации, образованием инертных оксидов или гидроксидов, которые обладают стабильной структурой. Эти факторы делают металлы нереактивными и неспособными взаимодействовать с солями.
Реакция солей с кислотами
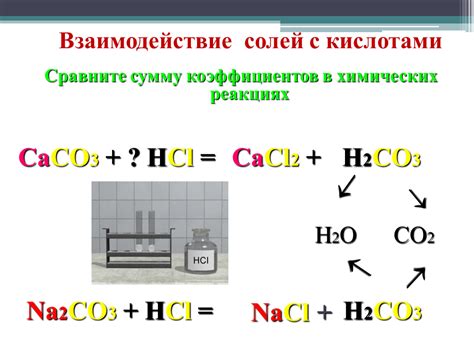
Соли, будучи химическими соединениями, обладают рядом особенностей взаимодействия с другими веществами. Одной из наиболее распространенных реакций солей является их реакция с кислотами.
Кислоты - это вещества, которые могут отдавать протоны (водородные ионы) в раствор, образуя гидроксиды или анионы. В свою очередь, соли содержат ионы металлов и кислотные остатки. При соприкосновении солей с кислотами может происходить обратная реакция: ионы металлов могут отдавать свои электроны и переходить в состояние ионов, вызывая образование новых соединений.
Реакция солей с кислотами осуществляется с образованием новых соединений и сопровождается обменом ионами. В результате этой реакции образуются гидроксиды металлов, названия которых выглядят следующим образом: [название металла] гидроксид. Также может образовываться отрицательный ион, который связывается с протонами кислоты и образует новую молекулу.
Изучение реакций солей с кислотами является важным в химии и имеет практическое применение. Например, на основе этих реакций возможно получение новых веществ или очистка растворов от нежелательных ионов.
Способность щелочных металлов к окислению

Окисление – это процесс, при котором атом или ион теряет электроны. Щелочные металлы, такие как литий, натрий и калий, обладают высокой способностью к окислению.
Главной причиной такой высокой способности щелочных металлов к окислению является их электронная структура. У всех щелочных металлов на самом внешнем энергетическом уровне находится один электрон. Этот электрон слабо притягивается ядром атома, что делает его легко доступным для потери.
Взаимодействуя с растворами солей, окисление щелочных металлов происходит при контакте их ионов со слабо связанными электронами других атомов или ионов. Щелочные металлы обладают гигантской ионизационной энергией, что облегчает окисление ионов других элементов, расположенных в том же растворе. Этот процесс приводит к образованию ионов щелочных металлов с более высокой валентностью.
Таким образом, способность щелочных металлов к окислению обусловлена их электронной структурой и гигантской ионизационной энергией. Это делает их активными веществами при взаимодействии с растворами солей и позволяет им активно участвовать в различных химических реакциях.
Особенности электрохимического потенциала щелочных металлов:
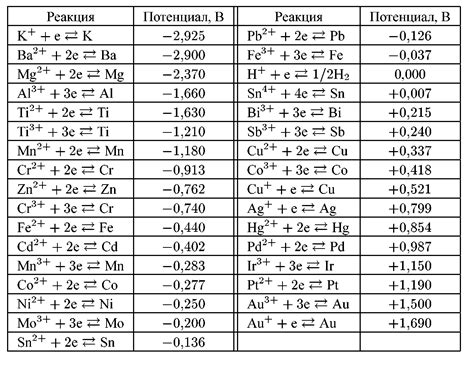
Щелочные металлы, такие как литий, натрий и калий, обладают высокими электрохимическими потенциалами, что объясняет их высокую реакционную способность. Это означает, что они имеют большую склонность к переходу электронов, что делает их активными в реакциях окисления-восстановления.
Электрохимический потенциал щелочных металлов прямо связан с их положением в ряду электрохимического ряда. В ряду щелочных металлов, литий имеет самый низкий электрохимический потенциал, а калий - самый высокий. Как следствие, литий наиболее активный щелочной металл.
Высокий электрохимический потенциал щелочных металлов является результатом их положительного электродного потенциала, который характеризуется высокими электронными аффинностями и низкими ионизационными энергиями. Это делает их более склонными к окислительным и редукционным реакциям и позволяет им проявлять высокую активность в химических преобразованиях.
Наличие высокого электрохимического потенциала также объясняет, почему щелочные металлы не реагируют с растворами солей. В растворах соединений щелочных металлов, ионы металлов уже находятся в ионизованном состоянии. Это значит, что ионы щелочных металлов имеют положительный заряд и электронно окружение, которое уже насыщено. Поэтому, щелочные металлы не могут перенять электроны от ионов раствора соли и продолжить реакцию.
Таким образом, особенности электрохимического потенциала щелочных металлов определяют их высокую реакционную способность и одновременно препятствуют их реакциям с растворами солей. Это важный фактор, который необходимо учитывать при исследовании свойств щелочных металлов и их соединений.
Взаимодействие щелочных металлов с водой

Щелочные металлы - это металлы первой группы периодической системы, включающие литий, натрий, калий, рубидий и цезий. Они отличаются высокой активностью и реактивностью. Когда щелочные металлы взаимодействуют с водой, происходит реакция, которая может быть довольно сильной и способной протекать с выделением большого количества тепла.
При взаимодействии с водой, металлы первой группы образуют гидроксиды. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водород. Уравнение этой реакции можно записать следующим образом:
2Na + 2H2O → 2NaOH + H2
Гидроксид натрия является щелочным раствором, и его классифицируют как простой гидроксид. Гидроксиды щелочных металлов обладают особенными физическими и химическими свойствами, такими как щелочная реакция и способность растворяться в воде.
Взаимодействие щелочных металлов с водой может быть очень интенсивным благодаря высокой активности металлов. Такие реакции часто сопровождаются выделением большого количества тепла. Поэтому при проведении таких экспериментов необходимо быть очень осторожными и соблюдать все меры безопасности.
В целом, взаимодействие щелочных металлов с водой является одним из способов использования этих металлов в различных сферах жизнедеятельности человека. Они часто применяются в производстве щелочи, препаратах, аккумуляторах и других областях, где их высокая активность и реактивность ценятся за их практическое значение.
Вопрос-ответ

Почему щелочные металлы не реагируют с растворами солей?
Щелочные металлы не реагируют с растворами солей из-за их химических свойств. Щелочные металлы являются очень активными элементами, и их реакционная способность прежде всего связана с их наличием одного электрона во внешнем энергетическом уровне. Это делает их очень реакционноспособными с другими веществами. Однако в растворе солей, этих металлов, происходит замещение катионов таких металлов на катионы находящиеся в растворе. Поэтому щелочные металлы не взаимодействуют с растворами солей и остаются нереактивными.
Почему щелочные металлы не образуют соли с другими металлами?
Щелочные металлы не образуют соли с другими металлами из-за огромной энергии их ионных связей. Ионное связывание в солях - это кулоновское взаимодействие противоположно заряженных ионов, которое требует значительной энергии для разрыва связи и образования новой. В случае взаимодействия щелочных металлов с другими металлами, такие ионные связи не могут быть сформированы из-за технологически сложных процессов, требующих значительной затраты энергии.
Почему реакция между щелочными металлами и растворами солей не происходит?
Ответ прост: реакция между щелочными металлами и растворами солей не происходит, потому что растворы солей уже содержат ионы металлов. Щелочные металлы имеют способность образовывать восстановители, а значит могут осуществлять реакцию с катионом, находящимся в растворе. Аналогично, катионы щелочных металлов могут замещать другие катионы, находящиеся в растворе солей. Реакции между щелочными металлами и растворами солей происходят только в случае, если раствор соли содержит кислоту, которую можно восстановить.
