Азотная кислота (HNO3) является одним из наиболее распространенных и важных химических соединений. Она широко используется в промышленности и научных исследованиях. Взаимодействие азотной кислоты с металлами вызывает интерес у ученых и инженеров, однако результаты этих взаимодействий не всегда предсказуемы.
Азотная кислота является сильным окислителем. Она способна окислять металлы, образуя соответствующие соли. Но почему при этом не происходит выделения металлического азота? Ответ на этот вопрос связан с особенностями структуры и свойств азотной кислоты, а также с электрохимическими реакциями, которые происходят во время ее взаимодействия с металлами.
Азотная кислота обладает высокой кислотностью благодаря наличию в ее составе неполярной кислородной группы -OH и двух полярных азотных групп -NO2. Эти группы образуют стабильное внутримолекулярное водородное связывание, что делает азотную кислоту не только кислотой, но и сильным окислителем. Взаимодействуя с металлами, азотная кислота может окислить их, но это может происходить не сразу, а после того, как окисление пройдет через несколько ступеней.
Взаимодействие азотной кислоты и металлов
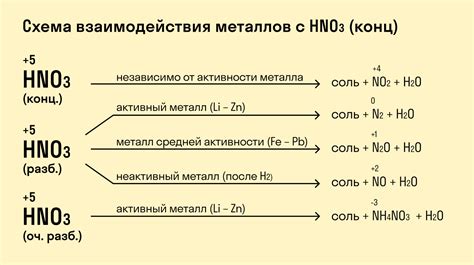
Азотная кислота, также известная как азотная активная сильная кислота, имеет формулу HNO3. Эта кислота является одним из самых сильных окислителей и способна реагировать с большим количеством веществ.
При взаимодействии азотной кислоты с различными металлами, обычно происходит образование нитратов металлов. Например, реакция азотной кислоты с железом приводит к образованию нитрата железа (Fe(NO3)3).
Однако, не все металлы способны реагировать с азотной кислотой. Некоторые металлы, такие как золото и платина, обладают высокой химической инертностью и не реагируют с кислотой.
Причина, по которой металлы не реагируют с азотной кислотой, связана с их электрохимическими свойствами. Металлы, которые реагируют с кислотой, имеют низкую электродонорную активность и могут быть окислены азотной кислотой. В то время как, более инертные металлы имеют высокую электронную плотность и малую склонность к окислению.
Также стоит учитывать, что азотная кислота может реагировать с металлами только при определенных условиях, таких как концентрация и температура. Высокая концентрация азотной кислоты и высокая температура могут ускорить реакцию между кислотой и металлом.
Итак, взаимодействие азотной кислоты и металлов зависит от электрохимических свойств металла, концентрации и температуры кислоты. Некоторые металлы реагируют с кислотой, образуя нитраты, в то время как другие металлы, такие как золото и платина, остаются инертными.
Почему нет выделения при реакции
Выделение газов
При взаимодействии азотной кислоты с некоторыми металлами, такими как цинк или железо, не происходит выделения газов. Это связано с тем, что азотная кислота является окислителем и может самостоятельно окислять металлы до более высоких оксидов, при этом металл не выделяется в виде газа. Вместо этого образуются азотные соединения с металлом.
Азотат металла
Реакция азотной кислоты с металлом приводит к образованию азотата металла, который обычно является твердым веществом и не выделяется в виде газа. Азотаты металлов могут иметь разные степени окисления металла и различные физические свойства, в зависимости от конкретной реакции и используемых реагентов.
Окислительные свойства азотной кислоты
Азотная кислота обладает сильными окислительными свойствами, поэтому она способна окислять металлы и другие вещества. В реакциях с металлами азотная кислота сама выступает в роли окислителя, что приводит к образованию азотата металла. При этом металл не выделяется в виде газа, так как все атомы металла участвуют в образовании окисленного соединения.
Исключения
Однако есть и исключения, при которых при реакции азотной кислоты с металлом может выделяться газ. Например, если в реакции присутствует вода, то азотная кислота может действовать как редуцирующее вещество, а не только как окислитель. В этом случае металл может быть выделен в виде соответствующего газа, такого как водород.
Выводы
Таким образом, отсутствие выделения при реакции азотной кислоты с металлами обусловлено ее сильными окислительными свойствами, которые позволяют ей окислять металлы и образовывать азотаты. При этом вещества могут иметь различные физические свойства и степени окисления металла.
Механизм реакции

Механизм взаимодействия азотной кислоты и металлов основан на химической реакции между ними. При этом происходит образование нитратов металлов и выделение едкой и ядовитой кислоты, кислорода и азота. Однако, в ряде случаев при взаимодействии некоторых металлов с азотной кислотой этого выделения не происходит.
Почему же нет выделения при реакции азотной кислоты с металлами? Дело в том, что реактивность металла играет основную роль. Некоторые металлы, такие как золото, платина и родий, обладают низкой реактивностью и составляют пассивную поверхность, которая защищает их от агрессивных воздействий окружающей среды, в том числе от азотной кислоты. Это объясняет отсутствие выделения в указанных случаях.
Кроме того, степень разбавления азотной кислоты и ее концентрация также могут влиять на возможность выделения. Высокая концентрация азотной кислоты способствует более активной реакции с металлами и, соответственно, выделению продуктов реакции. Однако, при сильном разбавлении азотной кислоты выделение может быть минимальным или отсутствовать вообще, поскольку концентрация и активность не достаточны для реакции.
Таким образом, появление или отсутствие выделения при реакции азотной кислоты с металлами зависит от их реактивности и концентрации азотной кислоты. Это важно учитывать при изучении взаимодействия этих веществ и его применении в различных областях науки и техники.
Ионизация азотной кислоты

Азотная кислота (HNO3) является сильной кислотой, которая может ионизироваться в водном растворе, образуя ионы азотной кислоты (NO3-) и протоны (H+). Ионизация азотной кислоты происходит в несколько этапов.
На первом этапе происходит разрыв полярной двойной связи между атомом азота и атомом кислорода, что приводит к образованию одной ионарийной связи между азотом и одним из атомов кислорода. В результате этого процесса образуется положительно заряженный ион азотия (NO2+) и отделяется один электрон.
На втором этапе ион азотия реагирует с водой, образуя оксониевый ион (H2NO3+). Протоны (H+) в растворе кислоты ионизируются во воду, формируя гидроксидные ионы (OH-) и образуя кислотные ионы (H2NO3+).
Эти ионы азотной кислоты могут дальше участвовать в других реакциях и взаимодействовать с различными металлами. В зависимости от природы металла и условий реакции, могут образовываться различные продукты взаимодействия.
Взаимодействие металла с азотной кислотой

Взаимодействие металлов с азотной кислотой может протекать по разным сценариям, в зависимости от свойств и реакционной способности конкретного металла. Азотная кислота является сильным окислителем и проявляет свою активность по отношению к некоторым металлам.
Некоторые металлы, такие как цинк, железо и алюминий, могут реагировать со сгущенной азотной кислотой. При этом происходит окисление металла, образуется соответствующий солевой комплекс и выделяется диоксид азота. Выделение диоксида азота в виде газа свидетельствует о протекании реакции между металлом и азотной кислотой.
Однако не все металлы реагируют с азотной кислотой с выделением газа. Например, ноблевые металлы – золото, платина и серебро – не реагируют с азотной кислотой при обычных условиях. Это связано с высокой инертностью данных металлов и их способностью к пассивации в кислотных средах.
Реакция металла с азотной кислотой также может зависеть от концентрации кислоты и ее температуры. Выделение диоксида азота может быть наблюдаемо только при определенных условиях.
В целом, взаимодействие металла с азотной кислотой зависит от химических свойств и степени реакционной активности металла. Результаты таких реакций могут быть использованы в разных областях, например, в производстве солей металлов или получении диоксида азота в промышленных масштабах.
Химические свойства азотной кислоты
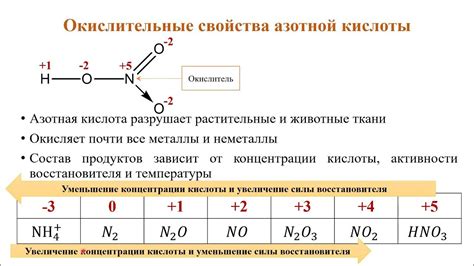
Азотная кислота является сильной двухосновной кислотой и хорошим окислителем. Она обладает рядом уникальных химических свойств, которые определяют ее широкое применение в различных областях.
Во-первых, азотная кислота способна разложиться с выделением кислорода и образованием нитритов и нитратов, что делает ее мощным окислителем. Это свойство позволяет использовать азотную кислоту в процессе нитрирования органических соединений, при синтезе взрывчатых веществ и в производстве удобрений.
Кроме того, азотная кислота способна образовывать соли с различными металлами. В результате реакции азотной кислоты с металлическими оксидами образуются соответствующие нитраты. Однако, взаимодействие азотной кислоты с металлами может быть ограничено рядом факторов, таких как пассивность металла, наличие защитной оксидной пленки, низкая концентрация кислоты и температура реакции.
Также стоит отметить, что азотная кислота обладает сильным действием на органические материалы, вызывая их окисление, дегидратацию и нитрацию. Это свойство позволяет использовать азотную кислоту в процессе очистки и обработки поверхностей, производстве полимерных материалов и других химических процессах.
Способы снижения реактивности

Реактивность азотной кислоты (HNO3) может быть снижена различными способами, что позволяет ее безопасно использовать при взаимодействии с металлами. Одним из таких способов является разведение азотной кислоты в воде. При разведении HNO3 образуется азотная кислота разной концентрации, в зависимости от количества воды, что позволяет контролировать и снизить ее реактивность.
Еще одним способом снижения реактивности является добавление к азотной кислоте определенных добавок или ингибиторов. Например, добавление серной кислоты (H2SO4) уменьшает окислительные свойства HNO3 и препятствует ее взаимодействию с металлами.
Также можно использовать хелатообразующие вещества, которые образуют стабильные комплексы с ионами металлов, что предотвращает их реакцию с азотной кислотой. Некоторые из таких хелатообразующих веществ включают этилендиаминтетрауксусную кислоту (EDTA) и диэтилентриаминпяцетатную кислоту (DTPA).
Другим методом снижения реактивности азотной кислоты является управление ее окружающей средой. Например, контролируя pH среды, можно регулировать активность HNO3. При нейтральном или щелочном pH азотная кислота менее активна и меньше реагирует с металлами.
Таким образом, существует несколько методов снижения реактивности азотной кислоты при взаимодействии с металлами. Использование этих способов позволяет безопасно проводить химические реакции и избежать возможных опасных последствий.
Вопрос-ответ

Почему азотная кислота не вызывает выделения металлов?
Азотная кислота обладает окислительными свойствами, но взаимодействие с металлами происходит лишь в ограниченных условиях. Дело в том, что азотная кислота реагирует с металлами при высоких концентрациях и при наличии катализатора, который принимает активное участие в реакции. Непосредственное взаимодействие азотной кислоты с металлами сопровождается образованием оксидов металла, но в данной ситуации наблюдается лишь окисление кислородом атомов металла, без выделения видимых осадков или газов.
Что происходит при взаимодействии азотной кислоты с металлами?
При взаимодействии азотной кислоты с металлами происходит реакция окисления металла, в результате которой образуются оксиды металла. Однако, обычно это происходит только в наличии катализатора и высоких концентраций кислоты. В противном случае, взаимодействие может быть медленным или совсем не происходить. Поэтому нет видимого выделения продуктов взаимодействия азотной кислоты и металлов.
