Окисление и восстановление — два основных процесса, происходящих в химических реакциях. Окисление представляет собой переход электронов от одного атома или иона к другому, при котором первый теряет электроны, а второй получает их. Восстановление же — обратный процесс, в результате которого атом или ион приобретает электроны, а другой переходит в окисленное состояние.
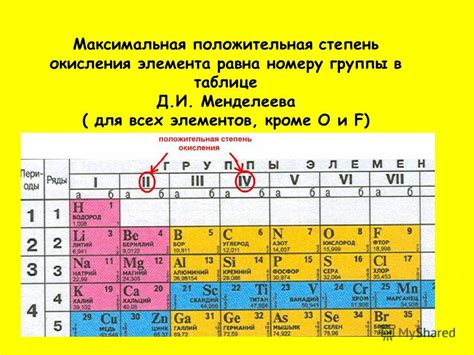
Степень окисления — это численное значение, выражающее количество электронов, переданных атомом или ионом в ходе окислительно-восстановительной реакции. Важной особенностью степени окисления является то, что для различных элементов она может быть как положительной, так и отрицательной.
Однако, если говорить о металлах, то они обладают способностью проявлять только отрицательные степени окисления. Это связано с устройством и электронной конфигурацией атомов металлов.
Металлы и их отрицательные степени окисления
Металлы - это элементы, обладающие способностью отдавать электроны и принимать положительные степени окисления. Однако, не все степени окисления металлов являются положительными. Некоторые металлы могут также проявлять отрицательные степени окисления.
Отрицательные степени окисления металлов возникают, когда металл связывается с другими элементами, обладающими более высокой электроотрицательностью. В таких соединениях металл обычно выступает в роли аниона, то есть электронного донора.
Примером металла с отрицательными степенями окисления является группа металлов из блока p периодической системы. Например, мыший, антимоний, висмут и полоний могут образовывать соединения с отрицательными степенями окисления.
Отрицательные степени окисления металлов имеют важное значение в химии и технологии. Они позволяют создавать специфические соединения и материалы с уникальными свойствами. Кроме того, отрицательные степени окисления металлов могут быть использованы в электрохимических реакциях и катализе.
В заключение, отрицательные степени окисления металлов представляют собой интересное явление в химии. Они позволяют металлам проявить свои уникальные свойства и участвовать во множестве химических реакций. Изучение отрицательных степеней окисления поможет лучше понять природу металлов и их химические свойства.
Что такое степени окисления металлов?
Степень окисления металла - это числовое значение, которое указывает на количество электронов, переданных металлом или принятых им во время окислительно-восстановительной реакции. Степень окисления может быть положительной или отрицательной, и она позволяет определить, насколько металл окислен или восстановлен.
Когда металл теряет электроны, его степень окисления становится положительной, так как он превращается в катион. В случае, когда металл получает электроны, его степень окисления становится отрицательной, так как он превращается в анион. Например, в окислительно-восстановительной реакции между железом и кислородом, железо теряет два электрона и его степень окисления становится +2, в то время как кислород получает эти два электрона и его степень окисления становится -2.
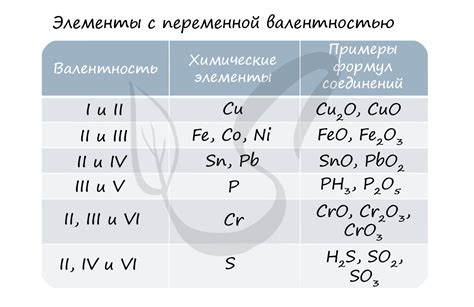
Степени окисления металлов могут использоваться для определения различных окислительных состояний металлов в соединениях. Например, медь может иметь степень окисления +1 или +2, в зависимости от оксиданта и условий реакции. Знание степени окисления металлов позволяет предсказывать и анализировать химические реакции, участвующие в окислительно-восстановительных процессах.
Часто степени окисления металлов представлены в форме римских цифр. Например, Fe(II) для железа со степенью окисления +2, Cu(I) для меди со степенью окисления +1. Это удобно для обозначения окислительного состояния металла и облегчает анализ химических реакций.
Почему металлы проявляют только отрицательные степени окисления?
Металлы являются элементами, которые обладают способностью отдавать электроны другим элементам. При окислении металлов происходит потеря электронов и образование ионов положительного заряда - катионов.
Отрицательные степени окисления металлов объясняются их положением в периодической системе элементов. Металлы находятся слева от линии деления металлов и неметаллов и имеют малое количество электронов в своей внешней оболочке.
Малое количество электронов во внешней оболочке обусловливает у металлов стремление отдать эти электроны, чтобы достичь стабильной конфигурации. При окислении металла происходит их потеря, в результате образуется позитивно заряженный ион металла.
Также, важную роль играет электроотрицательность элементов. Неметаллы, которые находятся справа от линии деления металлов и неметаллов, обладают высокой электроотрицательностью и имеют способность принимать электроны.
В результате, при контакте металла с неметаллом, металл отдает электроны неметаллу, что приводит к образованию ионов металла положительного заряда и ионов неметалла отрицательного заряда. Такое образование ионов приводит к появлению отрицательных степеней окисления металлов.
Влияние внешних факторов на степени окисления металлов
Степени окисления металлов могут быть влияние различными внешними факторами, которые определяются условиями окружающей среды и процессами, происходящими с данным металлом. Один из таких факторов - окислительная способность веществ, с которыми металл контактирует.
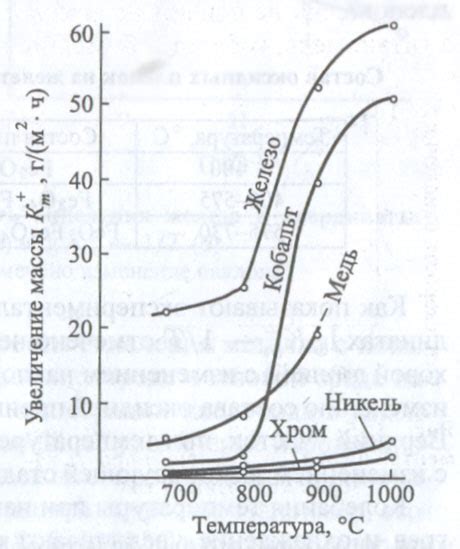
Высокое содержание кислорода или других химически активных веществ может привести к более высоким степеням окисления металлов. Это связано с тем, что окислительные вещества могут отбирать электроны у металла, что приводит к увеличению его окислительного состояния.
Также влияние на степени окисления металлов может оказывать температура окружающей среды. При высоких температурах металлы могут проявлять более высокие степени окисления, так как процессы окисления происходят более активно при повышенной энергии.
Некоторые металлы могут проявлять различные степени окисления в зависимости от своего окружения. Например, железо может иметь две основные степени окисления: +2 и +3. Это объясняется тем, что железо может участвовать в различных химических реакциях и образовывать разные соединения.
Наконец, процессы окисления металлов могут быть изменены в присутствии катализаторов. Катализаторы могут ускорять реакции окисления металлов и, соответственно, изменять их степени окисления.
В целом, степени окисления металлов могут быть изменены под влиянием различных внешних факторов, таких как окислительная способность веществ, температура, окружающая среда и наличие катализаторов. Эти факторы могут приводить к изменению окислительного состояния металлов и образованию различных соединений.
Список металлов с отрицательными степенями окисления
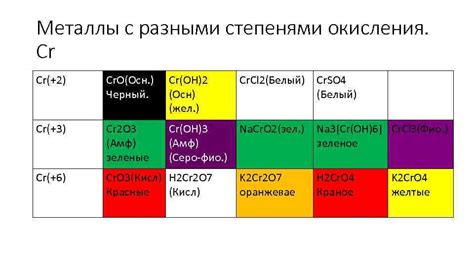
Отрицательные степени окисления металлов возникают, когда они переходят в ионы, отдавая электроны. Некоторые металлы могут проявлять отрицательные степени окисления в различных соединениях.
Вот несколько примеров:
- Медь (Cu): Образует соединения с отрицательными степенями окисления, такие как Cu2O, где медь ионизируется с -1.
- Железо (Fe): Степень окисления железа может быть отрицательной в соединениях, таких как Fe(SO4)2, где степень окисления железа составляет -2.
- Свинец (Pb): В соединениях, таких как PbS, степень окисления свинца составляет -2.
- Золото (Au): В некоторых соединениях, таких как AuCl2, степень окисления золота может быть -1.
Это лишь некоторые примеры металлов с отрицательными степенями окисления. Каждый металл может образовывать соединения с различными степенями окисления в зависимости от его химической активности и взаимодействия с другими элементами.
Практическое применение отрицательных степеней окисления металлов
Отрицательные степени окисления металлов играют важную роль в различных процессах и реакциях, что делает их практическое применение важным аспектом металлургической и химической промышленности.
Одним из основных способов использования металлов с отрицательными степенями окисления является их участие в электрохимических реакциях. К примеру, водородное выделение электролизом – процесс, в котором металлы с отрицательными степенями окисления выступают в роли электрода. Они принимают на себя электроны и участвуют в окислительно-восстановительной реакции.
Металлы с отрицательными степенями окисления также широко используются для производства различных химических соединений. Например, в химической промышленности металлы с отрицательными степенями окисления применяются для получения гидридов, галогенидов, оксидов и многих других соединений. Эти соединения имеют важное значение в таких отраслях, как фармацевтика, катализ и высокотемпературная техника.
Отрицательные степени окисления металлов также используются при получении специальных стекол и керамики. Металлы с отрицательными степенями окисления могут играть роль катализаторов, влияя на скорость химических реакций и обеспечивая необходимые условия для синтеза сложных структурных материалов.
Таким образом, практическое применение металлов с отрицательными степенями окисления обширно и разнообразно. Они находят свое применение в таких областях, как электрохимия, производство химических соединений, изготовление стекла и керамики, и оказывают значительное влияние на развитие промышленности и технологий.
Какие реакции происходят при образовании отрицательных степеней окисления у металлов?

Образование отрицательных степеней окисления у металлов является результатом специфических химических реакций, которые могут происходить с другими химическими веществами.
Одной из наиболее распространенных реакций является окисление металла с кислородом, известное как окисление. В этой реакции металл отдает электроны кислороду, что приводит к образованию положительного иона металла и отрицательного иона кислорода. Примером такой реакции является образование оксидов металлов, таких как оксид железа (Fe2O3) или оксид алюминия (Al2O3).
Другой тип реакции, приводящей к образованию отрицательных степеней окисления у металлов, это реакции с галогенами, такими как фтор, хлор, бром и йод. В этих реакциях металл отдает электроны галогену, образуя положительный ион металла и отрицательный ион галогена. Примером такой реакции является образование хлоридов металлов, таких как хлорид натрия (NaCl) или хлорид калия (KCl).
Также существует реакция металлов с неметаллами, в результате которой образуются соединения с отрицательным ионом металла. Например, реакция металла с серой может привести к образованию сульфидов металлов, таких как сульфид железа (FeS) или сульфид свинца (PbS).
Другие реакции, приводящие к образованию отрицательных степеней окисления у металлов, включают реакции с кислотами, основаниями и другими химическими соединениями. В результате этих реакций металл может образовывать соединения с различными степенями окисления, включая отрицательные.
В целом, образование отрицательных степеней окисления у металлов возникает в результате перераспределения электронов между металлом и другими химическими веществами, что приводит к образованию ионов с отрицательным зарядом металла. Эти реакции играют важную роль в химической промышленности и научных исследованиях.
Вопрос-ответ

Почему металлы проявляют только отрицательные степени окисления?
Металлы проявляют только отрицательные степени окисления из-за особенности ионизации атомов металла. При взаимодействии металла с окислителем, атомы металла отдают электроны и превращаются в положительно заряженные ионы. Ион металла имеет отрицательную степень окисления, так как он отдает свои электроны. Это происходит потому, что атомы металла имеют малую электроотрицательность и легко отдают электроны, стремясь достичь стабильной электронной конфигурации. Поэтому в химических соединениях, содержащих металлы, они имеют только отрицательные степени окисления.
Почему ионы металлов имеют отрицательные степени окисления?
Ионы металлов имеют отрицательные степени окисления в химических соединениях из-за процесса ионизации, при котором металл отдает свои электроны. Металлы обладают низкой электроотрицательностью, что означает, что они имеют большую способность отдавать электроны. Поэтому, когда металл вступает во взаимодействие с окислителем, он отдает электроны и становится положительно заряженным ионом. Положительная зарядка иона означает, что металл имеет отрицательную степень окисления в химическом соединении. Именно отдача электронов и приводит к формированию отрицательной степени окисления у ионов металлов.
