Электродное потенциал является важным параметром, характеризующим активность металлов и их способность вступать в реакции окисления и восстановления. В общем случае, металлы обладают положительным электродным потенциалом, что связано с их способностью отдавать электроны и служить анодом. Однако, существует небольшая группа металлов, которая обладает отрицательным электродным потенциалом. В данной статье мы рассмотрим причины подобного поведения металлов и объясним особенности их электрохимического поведения.
Одной из причин отрицательного электродного потенциала у некоторых металлов является их высокая активность и химическая реакционность. Металлы, такие как литий, калий и натрий, обладают очень низкой ионизационной энергией, что позволяет им легко отдавать электроны и образовывать положительные ионы. В результате, эти металлы имеют отрицательный электродный потенциал и проявляют высокую реакционность с окружающей средой.
Другой причиной отрицательного электродного потенциала у некоторых металлов являются их особенности внутренней структуры и электронной конфигурации. Например, самарий и тулий, редкоземельные элементы, имеют особенности в электронной структуре, которые приводят к образованию отрицательного электродного потенциала. Это связано с особенными реакциями переноса электронов и изменения заряда иона в процессе электрохимических реакций.
Таким образом, отрицательный электродный потенциал некоторых металлов обусловлен их высокой активностью и химической реакционностью, а также особенностями их электронной структуры. Изучение и понимание этих особенностей позволит расширить наши знания о металлах и их электрохимическом поведении.
Феномен отрицательного электродного потенциала

В химии и электрохимии электродный потенциал - это мера относительной силы окислительных и восстановительных свойств металлов. Обычно электродный потенциал золота считается нулевым. Однако существуют металлы, у которых отрицательный электродный потенциал.
Отрицательный электродный потенциал является результатом того, что энергия ионизации этих металлов выше, чем энергия окисления наиболее распространенного вещества - воды. Именно поэтому эти металлы не реагируют с водой и не окисляются в ее присутствии.
Некоторые из металлов с отрицательным электродным потенциалом - это химически инертные металлы, например, платина, золото и серебро. Они обладают высокой коррозионной стойкостью и химически не реагируют с большинством веществ, включая кислород и воду.
Другие металлы с отрицательным электродным потенциалом, такие как алюминий и цинк, обладают способностью образовывать защитные оксидные пленки на поверхности, что препятствует дальнейшей коррозии. Отрицательный электродный потенциал этих металлов связан с высокими степенями окисления их ионов в растворах.
Феномен отрицательного электродного потенциала имеет практическое применение. Металлы с отрицательным электродным потенциалом, такие как платина и золото, используются в химической промышленности и электрохимии для изготовления электродов, электронно-химических систем и каталитических процессов.
Связь между атомной структурой и электронными свойствами
Атомная структура материала имеет важное значение для его электронных свойств. Электронное поведение вещества определяется распределением электронов в его атомах и межатомных связях. Различные элементы могут иметь разные атомные структуры и, следовательно, различные электронные свойства.
В металлах атомы образуют кристаллическую решетку, в которой электроны свободно двигаются по всей структуре. Это связано с наличием свободных или делимных электронов в валентной зоне атомов металла. Это позволяет металлам проводить электричество и тепло, а также обладать отрицательным электродным потенциалом.
Некоторые металлы имеют отрицательный электродный потенциал из-за особенностей их атомной структуры. Например, металлы, такие как цинк и алюминий, имеют высокую аффинность к кислороду и способность образовывать окисленные соединения.
- Цинк имеет отрицательный электродный потенциал из-за наличия свободных электронов в валентной зоне и способности образовывать окисленные соединения.
- Алюминий также образует окисленные соединения и имеет отрицательный электродный потенциал.
Эти металлы могут реагировать с другими веществами, например, с кислородом или кислотами, и образовывать ионные соединения. Отрицательный электродный потенциал обусловлен способностью этих металлов отдавать электроны другим веществам.
В общем, атомная структура и связи вещества имеют прямую связь с его электронными свойствами. Это объясняет почему некоторые металлы имеют отрицательный электродный потенциал.
Группы металлов с отрицательным электродным потенциалом
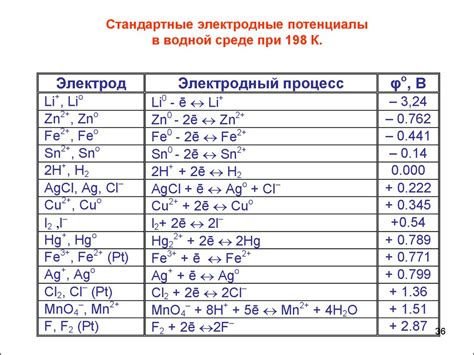
Отрицательный электродный потенциал связан с возможностью металла служить анодом в реакции окисления. Такие металлы обладают большей активностью по сравнению с другими металлами и способны отдавать электроны с большей легкостью.
Примером металлов с отрицательным электродным потенциалом являются щелочные металлы, такие как литий, натрий и калий. Они хорошо реагируют с водой, образуя гидроксиды и выделяя водород. Это объясняется высокой активностью этих металлов и их способностью отдавать электроны, чтобы образовать положительные ионы.
Другой группой металлов с отрицательным электродным потенциалом являются металлы из группы алюминиевых и циркониевых платиновых металлов. Их отрицательный электродный потенциал связан с высокой активностью их оксидов, которые имеют сильные окислительные свойства. Они способны отдавать электроны при взаимодействии с другими веществами.
Важно отметить, что отрицательный электродный потенциал может быть связан не только с химическими свойствами металла, но и с его структурой и электронной конфигурацией. Например, платина, хотя и является платиновым металлом, имеет положительный электродный потенциал, потому что ее электронная конфигурация делает ее нереактивной и устойчивой к окислению.
Влияние окружающей среды на электродный потенциал металлов
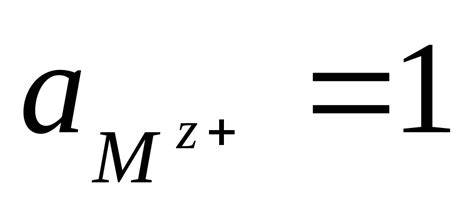
Электродный потенциал металлов является важным параметром, определяющим их химическую активность и способность к окислительно-восстановительным реакциям. Этот потенциал зависит от многих факторов, включая состав, структуру и температуру металла, а также от окружающей среды.
Окружающая среда может иметь значительное влияние на электродный потенциал металлов. Например, воздействие агрессивных химических веществ, таких как кислоты или соли, может привести к образованию пассивной пленки на поверхности металла. Это может привести к изменению электродного потенциала металла и его ослаблению.
Кроме того, окружающая среда может способствовать электрохимическому разложению воды на кислород и водород. При этом может происходить коррозия металла, что приводит к уменьшению его электродного потенциала.
Однако, существуют исключения, когда металлы имеют отрицательный электродный потенциал даже в нейтральной окружающей среде. Например, цинк имеет отрицательный электродный потенциал из-за способности растворяться в воде и образовывать ионы цинка. Также, у некоторых сплавов, таких как алюминиевые сплавы, может быть отрицательный электродный потенциал из-за наличия в них различных легирующих элементов.
Иногда, отрицательный электродный потенциал металлов может быть использован в практических целях. Например, в гальванических элементах отрицательный электродный потенциал является источником электродвижущей силы и используется для преобразования химической энергии в электрическую. Также, его можно использовать для защиты металлов от коррозии, создавая анодные защитные покрытия.
Причины высокого химического активности

1. Слабая связь между атомами. Одной из причин высокой химической активности некоторых металлов является слабая связь между атомами в их структуре. Большинство металлов обладает малым количеством валентных электронов и формируют слабые связи с другими элементами, что позволяет им активно участвовать в реакциях химического взаимодействия.
2. Низкая ионизационная энергия. Отрицательное электродное потенциал у металлов связан с их низкой ионизационной энергией. Металлы имеют тенденцию отдавать свои валентные электроны, образуя положительные ионы. Это делает их активными агентами в химических реакциях, так как они готовы взаимодействовать с другими веществами и образовывать новые химические соединения.
3. Высокая активность в реакциях окисления-восстановления. Металлы, имеющие отрицательное электродное потенциал, обычно хорошие окислители. Они легко отдают электроны окружающим веществам и активно вступают в реакции окисления-восстановления. Эта высокая активность связана с естественной способностью металлов образовывать положительные ионы и их стремлением к стабилизации электронной оболочки путем передачи электронов другим веществам.
4. Химическая реактивность. Металлы с отрицательным электродным потенциалом обычно обладают высокой химической реактивностью. Они быстро взаимодействуют с другими веществами, изменяют свою структуру и превращаются в соединения с новыми свойствами. Это свойство делает эти металлы ценными в индустрии и в различных химических процессах, где требуется быстрое и эффективное взаимодействие с другими веществами.
Применение металлов с отрицательным электродным потенциалом

Металлы с отрицательным электродным потенциалом находят широкое применение в различных отраслях науки и промышленности. Это связано с их особенностями и уникальными свойствами, которые позволяют использовать их в различных процессах и технологиях.
Одним из основных применений металлов с отрицательным электродным потенциалом является использование их в анодных процессах. Металлы с отрицательным электродным потенциалом обладают способностью к анодной реакции, то есть окислению, что позволяет их использовать в гальванических и электрохимических процессах. Например, аноды из металлов с отрицательным электродным потенциалом широко применяются в аккумуляторах и батареях различного назначения.
Еще одним применением металлов с отрицательным электродным потенциалом является их использование в анодных защитных покрытиях. Это связано с тем, что металлы с отрицательным электродным потенциалом способны цинковаться – образовывать защитную пленку из своих окислов на поверхности металла, что защищает его от коррозии и повреждений.
Также металлы с отрицательным электродным потенциалом могут применяться в качестве катализаторов в различных химических реакциях. Их использование в качестве катализаторов позволяет ускорить процессы взаимодействия и увеличить их эффективность. Это применение металлов с отрицательным электродным потенциалом широко используется в производстве катализаторов для нефтехимической и химической промышленности.
Таким образом, металлы с отрицательным электродным потенциалом имеют множество применений в различных отраслях и областях. Их уникальные свойства и способность к анодным реакциям позволяют использовать их для решения различных задач, начиная от энергетики и заканчивая химической промышленностью.
Вопрос-ответ

Почему некоторые металлы имеют отрицательное электродное потенциал?
Некоторые металлы имеют отрицательное электродное потенциал из-за разницы в реакционной активности этих металлов с водородом. Этот параметр определяется тем, насколько легко металл может отдать электроны и образовать положительные ионы. Металлы, имеющие отрицательное электродное потенциал, обладают высокой реакционной активностью и легко отдают электроны, что делает их более "активными" с точки зрения химических реакций.
Какой металл имеет самое отрицательное электродное потенциал?
Самым отрицательным электродным потенциалом среди всех металлов обладает свинец (Pb) с потенциалом около -0,13 В. Это связано с его высокой реакционной активностью и способностью легко отдавать электроны.
Можете ли вы объяснить, почему металлы с отрицательным электродным потенциалом считаются "активными"?
Металлы с отрицательным электродным потенциалом считаются активными, поскольку они обладают высокой реакционной активностью. Это означает, что они легко вступают в химические реакции, особенно с веществами, которые могут принять электроны (окислители). Такие металлы обычно являются хорошими восстановителями, способными отдавать электроны другим веществам.
