Окисление и восстановление — основные процессы, происходящие в химических реакциях. Во время окисления некоторые атомы или ионы теряют электроны, а во время восстановления они получают электроны. Это означает, что атомы и ионы ведут себя по-разному при участии в химической реакции. Особенно заметна разница в поведении металлов и неметаллов.
Металлы, как правило, имеют низкую электроотрицательность и большую склонность к окислению. Это означает, что они с легкостью отдают электроны другим атомам или ионам. Поэтому металлы обычно имеют положительную степень окисления в соединениях. Например, железо в соединении FeO имеет степень окисления +2, а свинец в соединении PbO имеет степень окисления +2. В то же время, когда металлы окисляются, они образуют ионы положительного заряда, называемые катионами.
В отличие от металлов, неметаллы имеют высокую электроотрицательность и склонность к восстановлению. Это означает, что они легко принимают электроны от других атомов или ионов в процессе химических реакций. Поэтому неметаллы, как правило, имеют отрицательную степень окисления в соединениях. Например, кислород в соединении H2O имеет степень окисления -2, а хлор в соединении HCl имеет степень окисления -1. В процессе восстановления неметаллы образуют ионы отрицательного заряда, называемые анионами.
Влияние степени окисления на свойства металлов и неметаллов

Степень окисления, или валентность, является важным параметром для определения свойств металлов и неметаллов. Она указывает на количество электронов, которые атом может потерять или приобрести во время химической реакции. Отрицательная степень окисления означает, что атом готов потерять электроны, в то время как положительная степень окисления указывает на готовность атома взять электроны.
Металлы, обладающие отрицательной степенью окисления, обычно являются добрыми восстановителями и реагируют с оксидами неметаллов, отдавая электроны. Они также обладают хорошей электропроводностью и обычно образуют ионные соединения с неметаллами.
С другой стороны, неметаллы с отрицательной степенью окисления обычно действуют в качестве окислителей. Они способны принимать электроны от металлов или других веществ, и их соединения могут быть кислотными или основными.
Степень окисления также может влиять на физические свойства металлов и неметаллов. Например, металлы с высокой степенью окисления могут образовывать более крепкие и твердые соединения, в то время как неметаллы с отрицательной степенью окисления могут образовывать более легкие и газообразные соединения.
В целом, степень окисления играет важную роль в понимании химических свойств металлов и неметаллов. Она помогает определить их взаимодействие с другими веществами и их поведение в химических реакциях.
Металлы

Металлы - это элементы периодической таблицы, которые проявляют отрицательную степень окисления. Они обладают отличными электропроводными свойствами и обычно являются твердыми веществами при комнатной температуре. Металлы обычно имеют блеск и высокую плотность.
Металлы обычно образуют ионы положительной степени окисления, отдавая электроны во время химических реакций. Они имеют способность образовывать катионы и поэтому часто вступают в реакции с анионами, такими как хлориды или сульфаты.
Металлы широко используются в различных отраслях промышленности. Они используются в производстве автомобилей, строительных материалов, электроники, судостроении и многих других областях. Некоторые примеры металлов включают железо, алюминий, медь, свинец, золото и серебро.
Металлы также могут быть разделены на различные классы в зависимости от их химических свойств и структуры. Например, благородные металлы, такие как золото и платина, обладают высокой устойчивостью к химическим реакциям, в то время как щелочные металлы, такие как натрий и калий, реагируют с водой.
Металлы также могут образовывать различные соединения с неметаллами. Эти соединения известны как соли и обладают широким спектром применений, от пищевой промышленности до фармацевтического производства.
Степень окисления и электрические свойства металлов
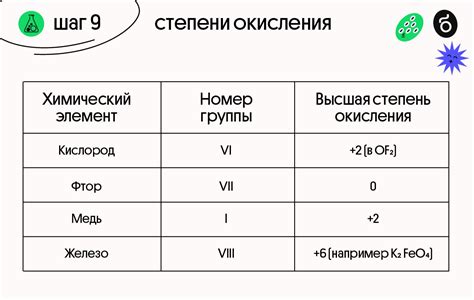
Металлы представляют собой группу элементов, обладающих характерными физическими и химическими свойствами. Одной из важных характеристик металлов является их степень окисления, которая играет решающую роль в их электрических свойствах.
Степень окисления металлов определяет их способность отдавать электроны. Большинство металлов имеют положительную степень окисления, так как они обладают малым количеством валентных электронов во внешней оболочке. Исключением являются активные металлы, такие как литий, натрий, калий, которые имеют степень окисления -1 при взаимодействии с неметаллами.
Электрические свойства металлов определяются их способностью проводить электрический ток. В основе этого лежит свободное движение электронов по кристаллической решетке металла. Благодаря малой степени окисления, металлы обладают высокой электропроводностью и хорошей теплопроводностью.
Кроме того, металлы обладают способностью образовывать ионы положительного заряда, которые встраиваются в структуру решетки металла и образуют межатомные связи. Это делает металлы прочными и пластичными, а также придает им способность проводить электрический ток даже в твердом состоянии.
Взаимодействие металлов с кислотами в зависимости от степени окисления

Металлы и неметаллы проявляют различную степень окисления при взаимодействии с кислотами. Металлы, имеющие более низкую степень окисления, легко реагируют с кислотами, образуя соли и выделяя водород. Например, щелочные металлы, такие как литий и натрий, реагируют с кислотами, образуя соли и выделяя водородный газ.
Металлы с более высокой степенью окисления, такие как железо и медь, менее активны при взаимодействии с кислотами. Они образуют соли, но при этом не выделяются большие объемы водорода. Например, железо реагирует с соляной кислотой, образуя соль железа(II) и выделяя малое количество водорода.
Однако, некоторые металлы с высокой степенью окисления, такие как алюминий и цинк, могут проявлять активность в отношении некоторых кислот. Например, алюминий реагирует с соляной кислотой, образуя соль алюминия и выделяя водород. Цинк также реагирует с соляной кислотой, образуя соль цинка и выделяя водород.
Таким образом, взаимодействие металлов с кислотами зависит от их степени окисления. Металлы с более низкой степенью окисления активнее реагируют с кислотами, образуя соли и выделяя водородный газ, в то время как металлы с более высокой степенью окисления проявляют меньшую активность при взаимодействии с кислотами.
Неметаллы

Неметаллы - это вещества, не обладающие металлическими свойствами и характеризующиеся низкой электропроводностью и хрупкостью. Они могут образовывать соединения с металлами и другими неметаллами.
Неметаллы могут иметь разные степени окисления, которые выражаются числами от -1 до +7. Отрицательная степень окисления означает преобладание электронов в соединении, при этом неметалл становится электроположительным и способен принимать электроны.
Наиболее известным неметаллом с отрицательной степенью окисления является кислород. Он способен образовывать соединения с другими элементами, при этом принимая на себя два электрона и образуя ионы с отрицательным зарядом.
Другим примером неметалла с отрицательной степенью окисления является хлор. В соединениях с другими элементами хлор может иметь степень окисления -1 и принимать на себя один электрон. Например, в соединении хлорида натрия (NaCl) хлор образует ион Cl-, который обладает отрицательным зарядом.
В общем случае, неметаллы с отрицательной степенью окисления образуют анионы, которые являются отрицательно заряженными ионами. Это позволяет им образовывать ионо-молекулярные соединения с положительно заряженными металлами или проявлять кислотные свойства.
Степень окисления и химическая активность неметаллов

Степень окисления неметаллов в химических соединениях может быть положительной, отрицательной или равной нулю. Отрицательная степень окисления неметаллов характеризует их способность принимать электроны от других атомов, проявляя окислительные свойства.
Неметаллы имеют высокую электроотрицательность, что позволяет им эффективно привлекать электроны к своему ядру. Они обладают способностью образовывать ковалентные связи с другими неметаллами и металлами, образуя молекулы и ионные соединения.
Окислительные свойства неметаллов проявляются при взаимодействии соединений с металлами, где неметалл принимает электроны от металла. Таким образом, неметаллы могут вступать в реакции окисления-восстановления, выступая в роли окислителя.
Примером неметаллов с отрицательной степенью окисления может служить хлор в хлористом ионе (Cl-) с окислением -1. Он проявляет окислительные свойства, способствуя окислению веществ с более низкой электроотрицательностью.
Сравнивая химическую активность неметаллов с металлами, можно отметить, что неметаллы обладают более высокой химической активностью за счет их способности к присоединению электронов и образованию сильных ковалентных связей.
Взаимодействие неметаллов с металлами в зависимости от степени окисления

Взаимодействие между неметаллами и металлами вещественных элементов может происходить при различных степенях окисления. Степень окисления является основным фактором, определяющим характер данной реакции.
В случае, когда неметалл имеет более высокую степень окисления, он может выступать в качестве окислителя, а металл будет выступать в качестве восстановителя. Этот тип взаимодействия называется окислительно-восстановительной реакцией. Например, кислород, имеющий степень окисления -2, может окислить металлы до положительных степеней окисления, образуя оксиды.
С другой стороны, когда металл имеет более высокую степень окисления, он может выступать в качестве окислителя, а неметалл будет выступать в качестве восстановителя. Эти реакции обычно происходят с участием хлора, брома или йода, которые могут вступать в реакцию с металлами, образуя соответствующие хлориды, бромиды или иодиды.
Также в процессе взаимодействия неметаллов с металлами возможно образование солей. Например, реакция между серой и железом может привести к образованию железного сульфида.
Все эти примеры демонстрируют, что взаимодействие неметаллов с металлами во многом зависит от степени окисления и может приводить к различным химическим реакциям, образованию оксидов, солей или других соединений.
Практическое применение отрицательной степени окисления металлов и неметаллов
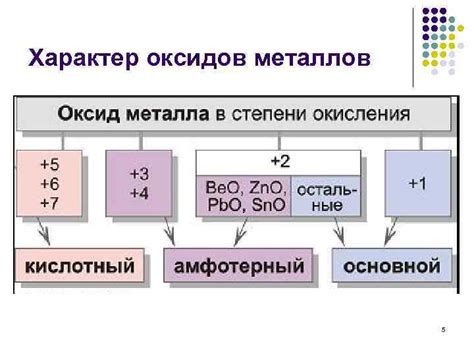
Отрицательная степень окисления металлов и неметаллов имеет широкий спектр практического применения в различных областях. В настоящее время существует множество процессов и технологий, основанных на использовании этого свойства.
Одним из наиболее распространенных применений отрицательной степени окисления металлов является использование их в качестве катализаторов. Катализаторы на основе металлов, таких как платина, никель или железо, активно применяются в химической промышленности для ускорения химических реакций. Некоторые металлы также используются в процессах газификации и водородных технологий.
В области электрохимии отрицательная степень окисления металлов имеет важное значение. Она используется для создания элементов электродов, таких как аноды и катоды, в различных аккумуляторах, батареях и электролизерах. Например, свинец используется в аккумуляторах автомобилей, а цинк и медь - в батареях и электролизерах.
Отрицательная степень окисления неметаллов также имеет практическое значение в различных отраслях. Например, фтор в соединении Криптон-фтор является мощным окислителем и используется в качестве пропелланта для ракетных двигателей. Кислород, как простейший неметалл, применяется в медицине для кислородотерапии и дыхательных аппаратах.
Кроме того, отрицательная степень окисления металлов и неметаллов используется при производстве цветных стекол, керамики, керамических пигментов и различных красителей. Также её важное значение имеет в металлургии при получении различных сплавов и металлических материалов.
В завершение, отрицательная степень окисления металлов и неметаллов является ключевым свойством, на основе которого разрабатываются новые материалы, технологии и процессы. Это позволяет совершенствовать различные отрасли промышленности, науки и техники, а также повышать эффективность и экологическую безопасность процессов.
Вопрос-ответ

Почему металлы и неметаллы проявляют отрицательную степень окисления?
Металлы и неметаллы проявляют отрицательную степень окисления из-за различных электрохимических свойств, которые они обладают. У металлов обычно меньше электроотрицательность, что делает их более склонными к окислению, тогда как неметаллы, с более высокой электроотрицательностью, имеют большую способность принимать электроны и, соответственно, проявляют положительную степень окисления.
В чем отличие между металлами и неметаллами по степени окисления?
Отличие между металлами и неметаллами по степени окисления заключается в том, что металлы обычно имеют отрицательную степень окисления, тогда как неметаллы имеют положительную степень окисления. Металлы, имея низкую электроотрицательность, имеют избыточные электроны и готовы их отдавать, в результате чего увеличивается их отрицательная степень окисления. Неметаллы же, с высокой электроотрицательностью, имеют дефицит электронов и готовы их принимать, что приводит к их положительной степени окисления.
