Галогены – это класс химических элементов, включающий в себя фтор, хлор, бром, иод и астат. Эти элементы обладают высокой электроотрицательностью и выраженными окислительными свойствами. Взаимодействие галогенов с металлами представляет особый интерес для химиков, поскольку это приводит к образованию различных соединений с уникальными свойствами.
Одной из основных особенностей взаимодействия галогенов с металлами является их способность образовывать ионы-галогениды, в которых металлический элемент переходит в катионное состояние, а галоген – в анионное состояние. Это происходит благодаря отдаче электронов от металла галогену. Такое взаимодействие возможно только при наличии свободных электронов в металлической структуре.
Взаимодействие галогенов с металлами происходит при высоких температурах и/или в уксусной кислоте. В результате этого процесса образуется ионно-молекулярное соединение, в котором галоген кислоты образует целевую молекулу, окруженную молекулами кислоты.
Важно отметить, что взаимодействие галогенов с металлами обладает множеством практических применений. Например, получение солей металлов является одним из основных способов синтеза различных химических соединений. Кроме того, галогены широко используются в химии и промышленности, включая процессы электролиза и сульфирования. Изучение взаимодействия галогенов с металлами помогает понять их химические свойства и расширяет возможности их применения в различных областях.
Углубленное изучение

Взаимодействие галогенов с металлами является важным объектом исследования в химии. Особенности и свойства этого взаимодействия помогают понять механизмы химических реакций и разработать новые материалы с улучшенными свойствами.
Ученые изучают такие факторы, как электроотрицательность галогена, его размер и степень одроности, а также тип металла и его электронную структуру. Понимание этих факторов позволяет предсказывать химические свойства системы галоген-металл и оптимизировать ее процессы.
Углубленное изучение взаимодействия галогенов с металлами также выявляет различные реакции, которые могут происходить при этом взаимодействии. Например, образование солей, ковалентной связи или сложных соединений с образованием галогенида металла. Эти реакции имеют важное значение для производства различных материалов и соединений.
Более глубокое понимание особенностей взаимодействия галогенов с металлами позволяет разрабатывать новые методы синтеза материалов с помощью контролируемых реакций. Это может привести к созданию новых материалов с высокой эффективностью и устойчивостью к внешним воздействиям.
Металлы и их химические реакции
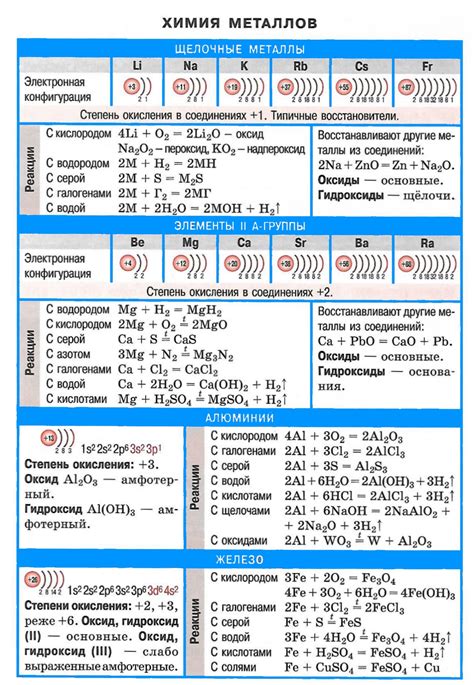
Металлы являются основной группой элементов, обладающих высокой электропроводностью и термической проводимостью. Взаимодействие металлов с другими веществами происходит в результате химических реакций, которые имеют свои особенности и свойства.
Одной из характерных особенностей химических реакций металлов является их способность вступать во взаимодействие с кислотами. При этом металлы могут выделять газы, например, взаимодействуя с соляной кислотой, они образуют хлориды и выделяются хлориды в виде газа. Образование соли и выделение газа является характерным признаком этой реакции.
Еще одной интересной химической реакцией металлов является их взаимодействие с водой. Некоторые металлы образуют гидроксиды и выделяются водородный газ. Реакция между металлом и водой сопровождается выделением тепла. В результате этой реакции образуется щелочь и выделяется водородный газ, который можно обнаружить с помощью специального испытания с горением.
Также металлы могут взаимодействовать с галогенами, например, хлором, и образовывать с ними соединения. При этом происходит реакция обмена, в результате которой металл замещается галогеном и образуется соответствующее галогенидное соединение металла.
Понятие галогенов

Галогены – это химическая группа элементов, включающих в себя фтор, хлор, бром, йод и астат. Эти элементы отличаются высокой электроотрицательностью, что делает их очень реакционными и способными к образованию прочных химических связей с другими элементами. Галогены находятся в группе 17 (VII A) периодической системы химических элементов и представляют собой неметаллы.
Каждый галоген имеет свойственные ему особенности и свойства. Фтор – самый электроотрицательный из всех элементов и обладает высокой реакционной способностью. Хлор является важным элементом в химической промышленности и используется для производства пластмасс и различных химических соединений. Бром находит применение как реагент в органическом синтезе и в производстве огнезащитных веществ. Йод используется в медицине и фармацевтике, астат – самый редкий и радиоактивный элемент группы.
Галогены обладают характерными физическими и химическими свойствами. Они являются газами или жидкостями при комнатной температуре, и только йод является твердым веществом. Галогены обладают ярким цветом, их пары обладают интенсивным запахом. Эти элементы высоко растворимы в воде и образуют кислотные оксиды. Галогены обладают высокой токсичностью и коррозионной активностью.
Взаимодействие металлов с галогенами

Взаимодействие металлов с галогенами является одним из важных процессов в химии. Галогены – это группа химических элементов, включающая фтор, хлор, бром и йод. Они обладают высокой электроотрицательностью, что делает их хорошими окислителями.
При взаимодействии металлов с галогенами происходит образование солей – хлоридов, бромидов или йодидов металлов. Обычно в реакциях участвуют металлы щелочных и щелочноземельных групп, такие как натрий, калий, магний и кальций. Галогены образуют с металлами ионные связи, что позволяет им образовывать стабильные соединения.
Реакции взаимодействия металлов с галогенами могут протекать с выделением энергии, поэтому такие реакции часто являются экзотермическими. При этом в реакционной смеси могут образовываться газы, например, при реакции натрия с хлором образуется хлорид натрия и выделяется хлор.
Основными факторами, влияющими на скорость и характер реакции взаимодействия металлов с галогенами, являются концентрация галогена, температура и поверхность металла. Более активные металлы реагируют с галогенами более интенсивно, чем менее активные.
- Примеры реакций:
- 2Na + Cl2 → 2NaCl
- Mg + Br2 → MgBr2
- Ca + I2 → CaI2
Взаимодействие металлов с галогенами имеет широкое применение в различных областях химии и технологий. Например, галогены используются в процессе галогенирования органических соединений, а также для очистки воды и консервации продуктов питания.
Особенности химических свойств

Взаимодействие галогенов с металлами имеет свои особенности и характерные свойства.
Во-первых, галогены являются сильными окислителями и обладают высокой электроотрицательностью. Это означает, что при контакте с металлами они способны отнимать у них электроны, вызывая окисление металла. Такое взаимодействие может привести к образованию ионов галогена и ионов металла с соответствующими зарядами.
Во-вторых, галогены могут образовывать соединения с металлами, которые отличаются высокой степенью полярности и часто имеют ионную структуру. В таких соединениях галогены играют роль отрицательных ионов, а металлы - положительных ионов. Такие соединения называются галоидами металлов.
В-третьих, галоидные соединения металлов обладают разнообразными физическими и химическими свойствами. Они могут быть кристаллическими или аморфными, растворимыми или нерастворимыми в воде, иметь различную степень токсичности и стать идеальными катализаторами для ряда химических реакций.
Также стоит отметить, что галоидные соединения металлов обладают характерными цветами. Например, хлориды, бромиды и йодиды некоторых металлов могут иметь белый, желтый, оранжевый, красный или фиолетовый цвет в твердом состоянии.
В таблице ниже представлены некоторые химические свойства галоидных соединений нескольких металлов.
| Металл | Ион металла | Галоид | Формула | Цвет | Растворимость в воде |
|---|---|---|---|---|---|
| Натрий | Na+ | Хлор | NaCl | Белый | Растворим |
| Калий | K+ | Бром | KBr | Белый | Растворим |
| Серебро | Ag+ | Иод | AgI | Желтый | Нерастворим |
Взаимодействие галогенов с различными металлами
Галогены представляют собой элементы группы VII периодической системы, которые обладают высокой реактивностью. Они могут взаимодействовать с различными металлами, образуя с ними соединения с различными свойствами и структурой.
Взаимодействие галогенов с металлами осуществляется путем образования ионных соединений или координационных соединений. Соединения галогенов с металлами отличаются высокой стабильностью и могут иметь различные структуры, в зависимости от типа металла и галогена.
Галогены обладают сильной электроотрицательностью, поэтому они обладают высокой способностью к приему электронного парамагнитного состояния. Это позволяет им образовывать стабильные ионы, которые с легкостью взаимодействуют с металлами.
Взаимодействие галогенов с металлами может приводить к образованию солей, когда галоген полностью замещает ионную часть металла. В таких случаях образующиеся соединения обычно обладают высокой растворимостью в воде и имеют свой характерный запах. Например, хлорид натрия - соль, которая образуется при взаимодействии хлора с натрием.
Кроме того, галогены могут формировать соединения с металлами в виде кородеев или взаимодействовать с ними как связующие бриджи. При этом образуются комплексные соединения, в которых галоген связан с металлом через координационную связь.
Применение и значение:

Взаимодействие галогенов с металлами имеет значительное применение в различных областях. Одним из наиболее важных применений является использование галогенов в процессе получения сплавов и композиционных материалов. Галогены способны образовывать соединения с металлами, которые обладают высокой прочностью и твердостью. Это делает их идеальным материалом для использования в строительстве, авиации и промышленности.
Взаимодействие галогена с металлом также имеет большое значение в электротехнике. Галогенные соединения металлов широко используются в производстве электронных компонентов, таких как полупроводники, диоды и транзисторы. Эти соединения обладают высокой электрической проводимостью и стабильностью, что позволяет им работать в экстремальных условиях.
Кроме того, галогенные металлы играют важную роль в химической промышленности. Они используются в качестве катализаторов в различных химических реакциях и процессах. Галогенные соединения металлов также применяются при производстве пластиков, резин и красителей.
Взаимодействие галогенов с металлами также имеет свое значение в медицине. Они используются в производстве лекарственных препаратов и средств для лечения различных заболеваний. Галогенные соединения металлов обладают антимикробными свойствами и могут быть использованы для борьбы с инфекциями и другими патогенными микроорганизмами.
Вопрос-ответ

Какова роль галогенов во взаимодействии с металлами?
Галогены играют важную роль во взаимодействии с металлами, так как они имеют высокую электроотрицательность и могут образовывать ионные связи с металлами. Это позволяет галогенам образовывать стабильные соединения с металлами и использоваться в различных химических реакциях и процессах.
Какие свойства галогенов делают их эффективными взаимодействующими с металлами?
Галогены, такие как фтор, хлор, бром и йод, обладают высокой электроотрицательностью, что позволяет им эффективно протекать взаимодействие с металлами. Кроме того, они образуют стабильные ионные соединения с металлами, что обеспечивает их способность реагировать и взаимодействовать с металлами.
Какие особенности есть у взаимодействия галогенов с металлами?
Одной из особенностей взаимодействия галогенов с металлами является то, что оно происходит с образованием стабильных ионных соединений. Также, реакция взаимодействия галогенов с металлами может протекать при различных условиях, включая высокие температуры и давления.
Какие применения и примеры взаимодействия галогенов с металлами существуют в промышленности?
Взаимодействие галогенов с металлами находит широкое применение в промышленности. Например, фтор используется для производства алюминия, хлор используется в процессе получения металлов с помощью электролиза, бром может использоваться для обработки металлических поверхностей, а йод применяется в процессах очистки металлов.
