В периоде периодической таблицы химических элементов первого варианта значительно отличаются атомы металлов и неметаллов. Они имеют различную структуру и характерные свойства, которые определяют их химические и физические проявления. Различия между этими двумя типами элементов играют важную роль в области химии и науки в целом.
Атомы металлов в периоде 1 выступают в качестве ионов положительного заряда, так как они готовы отдавать электроны. У атомов металлов обычно слабоэлектроотрицательная электронность, что обуславливает их способность образовывать ионы с отрицательным зарядом. Атомы металлов также обладают большей атомной массой, металлическим блеском и характерной металлической структурой, которая позволяет им проводить электрический ток.
Атомы неметаллов, напротив, имеют чаще всего электроотрицательный характер, что делает их способными принимать электроны и образовывать ионы с положительным зарядом. Атомы неметаллов обычно легче по массе и могут обладать различными формами: молекулярной, атомарной и др. Неметаллы не обладают металлическим блеском и не проводят электрический ток. Они могут образовывать различные химические связи и обладать различными свойствами, такими как газообразность или хрупкость.
Таким образом, различия между атомами металлов и неметаллов в периоде 1 являются существенными и определяют их химические и физические свойства. Атомы металлов обладают положительным зарядом и характерными свойствами, такими как металлический блеск и способность проводить электрический ток. Атомы неметаллов, наоборот, имеют отрицательный заряд и обычно не обладают металлическими свойствами. Это позволяет установить границу между этими двумя типами элементов и провести дальнейшие исследования в области химии.
В чем отличия атомов металлов и неметаллов в периоде?
1. Расположение в периодной таблице: Атомы металлов и неметаллов находятся на разных концах периодической таблицы элементов. Металлы располагаются слева от линии промежуточных элементов, а неметаллы - справа.
2. Физические свойства: Атомы металлов обладают металлическим блеском, хорошей термической и электрической проводимостью, а также высокой пластичностью и тугоплавкостью. В то время как атомы неметаллов могут быть в твердом, жидком или газообразном состоянии, обладают низкой термической и электрической проводимостью и могут образовывать легколетучие соединения.
3. Химические свойства: Атомы металлов обладают тенденцией отдавать электроны и образовывать положительные ионы (катионы), что делает их хорошими веществами для проведения токов. Атомы неметаллов, напротив, имеют тенденцию принимать электроны и образовывать отрицательные ионы (анионы), что делает их веществами с хорошей способностью кислотности и участию в химических реакциях.
4. Соединения: Атомы металлов имеют тенденцию образовывать ионы положительной заряды и образовывать ионные соединения с неметаллами. Например, ксеонатрий, NaXeO4. Атомы неметаллов, напротив, склонны образовывать ионы отрицательной заряды и соединяться с положительно заряженными ионами или другими неметаллами, образуя ковалентные соединения. Например, йодистый кислород, IO3-.
Отличия в физических свойствах
1. Точка плавления и кипения: Металлы, находящиеся в периоде, обычно имеют высокую точку плавления и кипения. Например, атомы металлов, таких как железо и свинец, имеют высокую точку плавления, что делает их твердыми при комнатной температуре. Неметаллы, напротив, имеют низкую точку плавления и кипения. Атомы неметаллов, таких как кислород и хлор, имеют низкую точку плавления и кипения, что позволяет им находиться в газообразном состоянии при комнатной температуре.
2. Проводимость электричества и тепла: Металлы в периоде обычно являются хорошими проводниками электричества и тепла. Атомы металлов обладают свободными электронами, которые могут легко перемещаться между атомами, создавая электрический и тепловой поток. Неметаллы, напротив, обычно являются плохими проводниками электричества и тепла. Атомы неметаллов имеют сильные электронные связи и отсутствие свободных электронов, что затрудняет перемещение электрического и теплового потока.
3. Механические свойства: Металлы в периоде обычно обладают хорошей механической прочностью и твердостью. Атомы металлов формируют кристаллическую структуру, что придает им высокую прочность. Неметаллы, в свою очередь, обычно имеют более хрупкую структуру и низкую прочность. Атомы неметаллов образуют молекулярные или ионные связи, которые легко разрушаются при механическом воздействии.
Отличия в химических свойствах

Атомы металлов и неметаллов в периоде отличаются по ряду химических свойств, что определяет их роль и реакционную способность. Вот несколько основных отличий:
- Электроотрицательность: Металлы обычно имеют более низкую электроотрицательность по сравнению с неметаллами. Это означает, что металлы имеют большую склонность отдавать электроны, а неметаллы - принимать электроны.
- Ионизационная энергия: Ионизационная энергия - это энергия, необходимая для отрыва одного электрона от атома. Атомы металлов обычно имеют более низкую ионизационную энергию, что означает, что они легче теряют электроны, чем атомы неметаллов, у которых ионизационная энергия выше.
- Формирование ионов: Из атомов металлов образуются положительно заряженные ионы (катионы), так как они отдают электроны. Атомы неметаллов, напротив, набирают электроны и образуют отрицательно заряженные ионы (анионы).
- Окислительно-восстановительные свойства: Металлы, из-за своей склонности отдавать электроны, обычно выступают в реакциях в качестве окислителей, тогда как неметаллы, принимая электроны, могут действовать в реакциях в качестве восстановителей.
- Свойства соединений: Соединения металлов и неметаллов обычно имеют различную природу. Соединения металлов, как правило, являются ионными и образуют кристаллическую решетку, а соединения неметаллов могут быть как ионными, так и молекулярными.
Эти отличия в химических свойствах между атомами металлов и неметаллов в периоде определяют их различные роли в химических реакциях и их влияние на физические и химические свойства веществ.
Отличия в возможности образования ионов

Атомы металлов и неметаллов в периоде имеют различные способности образования ионов. Металлы имеют тенденцию образовывать положительно заряженные ионы, называемые катионами, путем потери одного или нескольких электронов из внешней энергетической оболочки. Неметаллы, напротив, образуют отрицательно заряженные ионы, называемые анионами, путем приобретения одного или нескольких электронов во внешней энергетической оболочке.
Металлы, благодаря свойству отдавать электроны, имеют низкую электроотрицательность, что обуславливает их способность легко ионизироваться. Это означает, что металлы образуют преимущественно положительные ионы с небольшим радиусом и высоким зарядом, так как у них внешняя оболочка содержит малое количество электронов. Более того, электроны в металлах могут легко передвигаться, обеспечивая проводимость электрического тока в металлических соединениях.
Неметаллы, однако, имеют высокую электроотрицательность и обладают способностью принимать электроны. В результате это приводит к образованию отрицательно заряженных ионов с большим радиусом и меньшим зарядом. Относительно большое количество электронов во внешней оболочке неметаллов создает сильную электростатическую отталкивающую силу между ними и обуславливает их хрупкость и низкую теплопроводность.
Отличия в привлекательной силе ядра

Ядро атома металла и ядро атома неметалла отличаются в привлекательной силе.
У атомов металлов привлекательная сила ядра к электронам обычно слабее, чем у атомов неметаллов. Это связано с тем, что у атомов металлов наружная электронная оболочка имеет меньшую электростатическую плотность заряда, что делает их менее привлекательными для электронов. Это объясняет относительную легкость эмиссии или потери электронов атомами металлов.
С другой стороны, у атомов неметаллов наружная электронная оболочка имеет большую электростатическую плотность заряда, что делает их более привлекательными для электронов. Это приводит к тому, что атомы неметаллов имеют склонность к привлечению электронов и образованию отрицательно заряженных ионов.
Отличия в привлекательной силе ядра атомов металлов и неметаллов сказываются на их химических свойствах. Металлы обычно обладают металлическими свойствами, такими как хорошая электропроводность и гибкость, в то время как неметаллы чаще проявляют неметаллические свойства, включая плохую электропроводность и хрупкость.
Отличия в плотности и температуре плавления
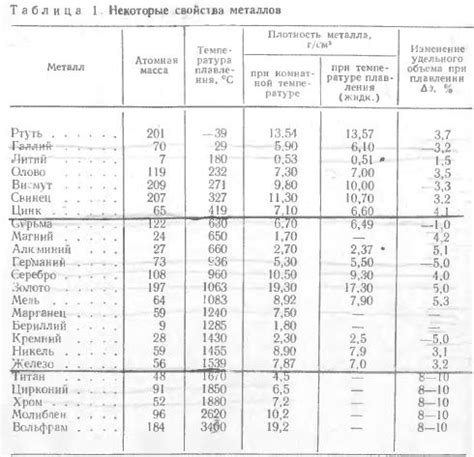
Металлы и неметаллы отличаются друг от друга в плотности и температуре плавления. Плотность металлов обычно выше, чем у неметаллов. Это объясняется особыми свойствами металлической структуры, в которой атомы металлов располагаются в регулярной кристаллической решетке.
Например, атомы железа, которое является металлом, располагаются близко друг к другу в кристаллической структуре, что делает его плотным материалом. В то же время, неметаллы, как правило, имеют менее плотную структуру и, соответственно, ниже плотность.
Температура плавления также различается у металлов и неметаллов. В большинстве случаев, металлы обладают высокой температурой плавления. Например, сталь плавится при очень высокой температуре около 1370 градусов Цельсия, в то время как такие неметаллы, как карбон и сера, плавятся при намного более низких температурах.
Эти различия в плотности и температуре плавления обусловлены разными типами связей между атомами. В металлах, связь происходит за счет общей электронной оболочки, что делает структуру упакованной и устойчивой, а в неметаллах атомы связаны ковалентными связями, что делает структуру менее плотной и более легкой для плавления.
Вопрос-ответ

