Щелочные металлы являются основными элементами в периодической системе химических элементов. Эти металлы, такие как литий, натрий, калий, рубидий, цезий и франций, имеют низкую плотность и низкую температуру плавления, а также отличаются высокой химической активностью.
Одно из главных отличительных свойств щелочных металлов - их способность гореть, взрываться или реагировать с водой и кислородом. Например, литий обладает самой высокой степенью реактивности среди щелочных металлов и может загораться при контакте с кислородом или даже воздухом. Натрий, калий и другие щелочные металлы также проявляют схожую реактивность.
Щелочные металлы также известны своей способностью растворяться в воде и образовывать щелочные растворы. Эта способность объясняется высоким электроотрицательностью щелочных металлов, что позволяет им образовывать ионы гидроксида. Например, когда натрий растворяется в воде, он образует щелочной раствор (раствор гидроксида натрия), что придает ему щелочные свойства.
Химическая активность щелочных металлов
Химическая активность щелочных металлов проявляется в том, что они легко образуют соединения с другими элементами. Это обусловлено тем, что щелочные металлы имеют всего один электрон во внешней электронной оболочке, что делает их нестабильными и стремящимися к образованию химических связей с другими атомами.
Помимо этого, щелочные металлы обладают высокой реактивностью и способностью образовывать ионы с положительным зарядом. Это связано с тем, что они легко отдают свой единственный электрон, что ведет к образованию положительно заряженных ионов. Например, когда натрий реагирует с хлором, образуется соединение - хлорид натрия, где натрий отдает свой электрон, становясь ионом с положительной зарядом, а хлор принимает этот электрон, становясь ионом с отрицательной зарядом.
Многообразие применения щелочных металлов
Щелочные металлы имеют широкий спектр применения в различных областях. Например, литий широко используется в производстве аккумуляторов, а калий является одним из основных компонентов удобрений, так как необходим для роста растений. Щелочные металлы также используются в производстве стекла, электродов и аллойев, а также в других промышленных и научных процессах.
Кроме того, некоторые щелочные металлы, такие как литий и натрий, применяются в лекарствах и медицине. Литий используется для лечения психических расстройств, таких как биполярное расстройство, а натрий применяется в растворах для внутривенного вливания при дегидратации и других медицинских состояниях.
Щелочные металлы являются неотъемлемой частью нашего жизненного пространства и находят широкое применение в различных областях науки, промышленности и медицины. Их отличительные свойства, такие как химическая активность и реактивность, делают их важными и необходимыми элементами в многих процессах и приложениях.
Отличительные свойства щелочных металлов

Щелочные металлы – это группа элементов периодической таблицы, которые характеризуются рядом отличительных свойств. Вот основные из них:
- Химическая активность: Щелочные металлы являются самыми активными металлами в периодической таблице. Они легко вступают в реакцию с водой, кислотами и многими другими веществами. Это связано с тем, что у них одна электронная оболочка, которая готова отдать электрон, чтобы образовать положительный ион.
- Реактивность: Щелочные металлы реагируют с водой, образуя щелочные растворы. Например, реакция натрия с водой даёт гидроксид натрия и выделяет водород. Эти металлы также реагируют с кислородом, образуя оксиды. Щелочные металлы могут вступать в реакцию с аммиаком и образовывать комплексы.
- Низкая плотность: Щелочные металлы обладают низкой плотностью. Например, литий – самый лёгкий металл в периодической таблице. Это связано с особенностями строения атомов и их способностью составлять металлическую решётку с большими промежствиями между атомами.
- Сильные основания: Щелочные металлы образуют гидроксиды, которые являются сильными основаниями. Они растворяются в воде, образуя щелочные растворы и выделяя тепло. Гидроксиды щелочных металлов широко используются в различных областях, включая производство мыла, стекла и химических реактивов.
Щелочные металлы играют важную роль в химической промышленности и технологиях. Их отличительные свойства делают их полезными в различных областях, включая электронику, энергетику и металлургию.
Химическая активность щелочных металлов

Щелочные металлы – это элементы группы 1 в периодической системе Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Одной из основных характеристик этих металлов является их высокая химическая активность.
Химическая активность щелочных металлов обусловлена тем, что они обладают только одним электроном в валентной оболочке. В результате этого электронного конфигурация щелочных металлов становится нестабильной, что приводит к их интенсивной реакционной способности.
Щелочные металлы легко реагируют с водой, образуя щелочи и выделяя водород. Например, натрий при контакте с водой быстро реагирует, и на поверхности воды образуется щелочное растворение гидроксид натрия (NaOH) и выделяется водородный газ (H2).
Кроме того, щелочные металлы реагируют со многими неорганическими и органическими веществами, например, с кислородом, серой, аммиаком и другими. Они также активно взаимодействуют с кислотами, образуя соль и выделяя водород. Это свойство щелочных металлов широко используется в различных химических процессах и промышленности.
Химическая активность щелочных металлов является основой для их применения в различных областях науки и техники. Они используются в производстве щелочей, легировании сталей, производстве взрывчатых веществ, компонентах аккумуляторов и других устройствах.
Реактивность щелочных металлов
Щелочные металлы – это элементы первой группы периодической системы, включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Их реактивность является одной из наиболее характеристических особенностей.
Все щелочные металлы обладают сильной химической активностью, что проявляется в их способности образовывать химические соединения с различными элементами и группами веществ. Они реагируют с водой, кислородом, галогенами и другими неорганическими соединениями.
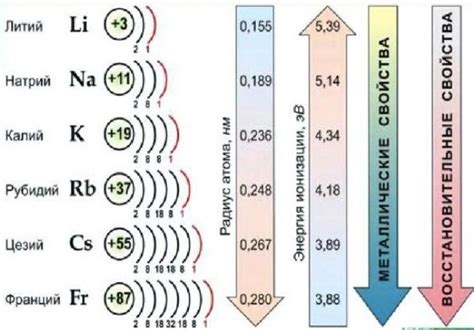
Реактивность щелочных металлов возрастает по мере их движения вниз по группе. Например, литий самый реактивный из щелочных металлов, а франций является наиболее реактивным элементом этой группы.
Самой известной реакцией щелочных металлов является реакция с водой. При контакте с водой они образуют щелочь и выделяются водород. Например, натрий реагирует с водой, образуя гидроксид натрия (щелочь) и выделяя водород:
2Na + 2H₂O → 2NaOH + H₂
Щелочные металлы также реагируют с кислородом, образуя оксиды. Например, литий сгорает при контакте с кислородом и образует оксид лития:
4Li + O₂ → 2Li₂O
Кроме того, щелочные металлы реагируют с галогенами (фтор, хлор, бром, йод), образуя соли. Например, натрий реагирует с хлором, образуя хлорид натрия:
2Na + Cl₂ → 2NaCl
Таким образом, реактивность щелочных металлов связана с их способностью легко образовывать соединения с другими веществами. Это делает их широко используемыми в различных сферах, таких как промышленность, медицина и научные исследования.
Химические свойства щелочных металлов

Щелочные металлы являются самыми активными элементами в периодической системе, благодаря чему они проявляют высокую химическую активность. Их атомы легко отдают один электрон, образуя положительно заряженные ионы, что позволяет им образовывать и множество соединений и реагировать с различными веществами.
Основное химическое свойство щелочных металлов - их способность сильно реагировать с водой. При контакте с водой они образуют гидроксиды и высвобождаются водород. Такая реакция характерна для всех щелочных металлов, но их активность в этой реакции может варьироваться в зависимости от периода и группы в периодической системе. Калий и натрий, наиболее распространенные элементы группы щелочных металлов, реагируют очень активно с водой.
Еще одно важное свойство щелочных металлов - их способность образовывать соли. Они реагируют с кислотами, образуя соли и выделяя водород. Образование солей происходит по простой реакции: щелочный металл + кислота = соль + водород. Такие реакции широко используются в химической промышленности для получения различных типов солей, в том числе пищевых добавок.
Некоторые щелочные металлы также способны реагировать с кислородом, образуя оксиды. При нагревании воздуха они горят и образуют оксиды, которые могут быть использованы в процессе производства стекла, керамики и других материалов. Например, натрий при горении образует оксид натрия, который является одним из главных компонентов стекла.
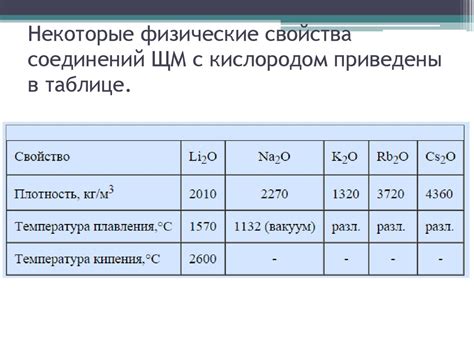
Физические свойства щелочных металлов

Щелочные металлы - это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они отличаются рядом физических свойств, которые делают их особенными и полезными в различных областях науки и технологий.
Первым заметным физическим свойством щелочных металлов является их низкая плотность. Это связано с тем, что атомы щелочных металлов имеют больший объем, чем другие элементы. Низкая плотность делает эти металлы легкими и подвижными, что обеспечивает легкость их использования в различных технических приложениях.
Еще одним характерным свойством щелочных металлов является их мягкость. Они мягко режутся ножом и могут быть деформированы простым давлением. Это объясняется слабостью связи между атомами в их кристаллической решетке. Мягкость щелочных металлов позволяет им использоваться для создания различных форм и изделий.
Щелочные металлы обладают высокой теплопроводностью. Они хорошо проводят тепло, что делает их полезными в различных технических приложениях, включая производство термоэлементов и охлаждающих систем.
Кроме того, щелочные металлы обладают хорошей электропроводностью. Это связано с наличием свободных электронов в их кристаллической решетке. Электропроводность щелочных металлов позволяет им использоваться в различных электронных и электрических устройствах.
Практическое применение щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкий спектр практического применения, благодаря их уникальным свойствам и химической активности.
1. Производство сплавов: Щелочные металлы широко используются в производстве сплавов с другими металлами, такими как алюминий, кадмий и свинец. Эти сплавы обладают высокой прочностью и стойкостью к коррозии, что делает их жизнеспособными для применения в различных отраслях, включая авиацию, автомобильную промышленность и строительство.
2. Производство щелочных элементов: Литий, натрий, калий и др. используются для производства щелочных элементов, таких как щелочные батареи, которые широко применяются в портативных электронных устройствах, таких как мобильные телефоны и ноутбуки. Эти элементы обладают высокой энергетической плотностью и обеспечивают длительное время работы устройств.
3. Производство стекла и керамики: Калий и другие щелочные металлы используются в производстве стекла и керамики. Добавление щелочных металлов в процессе производства позволяет снизить температуру плавления и улучшить оптические свойства материалов. Поэтому стекло и керамика, содержащие щелочные металлы, являются прозрачными и имеют высокую прочность и стойкость.
4. Производство щелочных галогенидов: Щелочные металлы используются для производства щелочных галогенидов, таких как хлориды, бромиды и иодиды. Эти вещества широко применяются в медицине, фармацевтической промышленности и высокотехнологичных процессах, таких как производство полупроводников и электронных компонентов.
5. Поглотители сливочного камня и утилизация отходов: Натрий используется в качестве поглотителя сливочного камня, который используется для очистки воды от органических примесей и отходов. Кроме того, щелочные металлы также используются в процессах утилизации отходов и очистки сточных вод.
Щелочные металлы играют важную роль в современных технологиях и применяются во многих отраслях промышленности, научных исследований и повседневной жизни.
Вопрос-ответ

Каково отличительное свойство щелочных металлов?
Отличительным свойством щелочных металлов является их высокая химическая активность.
Что обуславливает химическую активность щелочных металлов?
Химическую активность щелочных металлов обуславливает их электроотрицательность и низкая ионизационная энергия.
Как щелочные металлы реагируют с водой?
Щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород.
Что еще интересного можно узнать о щелочных металлах?
Щелочные металлы имеют низкую плотность, низкую температуру плавления и высокую теплопроводность.