Атомы металлов являются основными строительными блоками, из которых состоят металлические соединения и материалы. По своим химическим и физическим свойствам они отличаются от атомов неметаллов и газообразных элементов. Главной особенностью атомов металлов является наличие большого количества свободных, легко перемещающихся электронов в их валентной оболочке.
Атомы металлов обладают высокой основной ионизационной энергией, что позволяет им образовывать положительные ионы и присоединяться к другим атомам, образуя кристаллическую решетку. Именно благодаря этому свойству металлы обладают легкостью проводить ток электричества и тепло, что делает их основными материалами для производства электроники, проводников, нагревательных элементов и других устройств.
Другой отличительной особенностью атомов металлов является их способность к образованию металлической связи. Это особый тип связи, который формируется благодаря электронам валентной оболочки, свободно перемещающимся между атомами. Это обеспечивает высокую пластичность и податливость металлов, позволяющую им быть легко прокатываемыми, изгибаемыми и прессованными в различные формы, что делает их особенно применимыми в машиностроении и производстве различных изделий.
Итак, отличительные особенности атомов металлов, такие как наличие свободных электронов, способность образовывать положительные ионы и металлическую связь, делают их уникальными и важными для множества промышленных процессов. Благодаря своим свойствам, металлы являются неотъемлемой частью современной технологии и играют важную роль в нашей повседневной жизни.
Химические элементы и их особенности
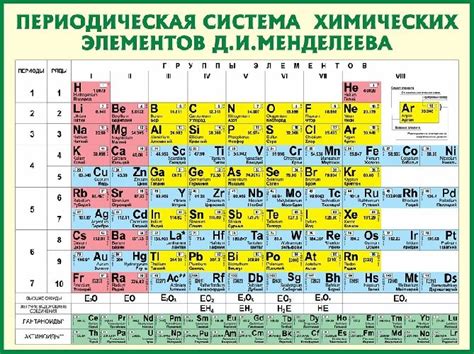
Атомы металлов имеют ряд отличительных особенностей, которые делают их уникальными в химии. Одна из таких особенностей - наличие свободных электронов. Металлы отдают электроны легко, благодаря своей низкой электроотрицательности и большому размеру атома.
Элементы, обладающие свободными электронами, проявляют ряд свойств, которые делают металлы особенными по сравнению с другими химическими элементами. Одно из таких свойств - электропроводность. Металлы хорошие проводники электричества, так как свободные электроны могут свободно перемещаться по металлической решетке.
Другим важным свойством металлов является их способность образовывать металлическую связь. Металлическая связь - это силовое взаимодействие между положительно заряженными ионами металла и свободными электронами. Именно благодаря металлической связи металлы обладают такими характерными свойствами, как пластичность, прочность и теплопроводность.
Уникальные свойства металлов делают их незаменимыми в различных областях жизни. Металлы широко применяются в производстве строительных материалов, автомобилей, электронной техники и многих других отраслях промышленности. Благодаря своим физическим и химическим свойствам, металлы играют важную роль в нашей повседневной жизни.
Атомы металлов и их структура
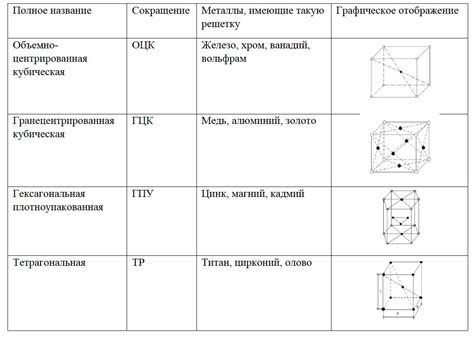
Атомы металлов имеют особенную структуру, которая отличается от структуры атомов других элементов. Эта особенность объясняет множество уникальных свойств металлов.
В основе структуры атомов металлов лежит их внутренняя организация. Атомы металлов обладают большим количеством электронов в своей внешней оболочке. Это делает их электронно-положительно заряженными и позволяет им легко образовывать ионы с положительной зарядом.
Еще одной отличительной особенностью атомов металлов является их способность образовывать кристаллическую решетку. Атомы металлов упаковываются в регулярные структуры, которые образуют кристаллическую сетку. Это приводит к образованию металлического связующего, который является одним из ключевых факторов, обеспечивающих металлическую проводимость.
Кроме того, атомы металлов обладают высокой подвижностью электронов. Это связано с тем, что электроны в металлах образуют так называемое "море" свободных электронов, которые способны свободно перемещаться по структуре металла. Это объясняет высокую электропроводность и теплопроводность металлов.
Выводя все это воедино, можно сказать, что особенные структура и свойства атомов металлов являются основой для их широкого использования в различных областях, таких как электроника, строительство, авиация и многое другое.
Электронная оболочка и ее влияние

Электронная оболочка является одной из главных отличительных особенностей атомов металлов. Она состоит из электронных орбиталей, на которых располагаются электроны. Именно электроны, находящиеся в внешней оболочке, играют ключевую роль в определении химических и физических свойств металлов.
Электроны в внешней оболочке металлических атомов имеют свободное движение и могут легко перемещаться от одного атома к другому. Это явление называется электронной подвижностью и обуславливает основные физические свойства металлов, такие как высокая электропроводность и теплопроводность.
Электроны во внешней оболочке металлических атомов образуют так называемое "море электронов", которое окружает положительно заряженные ядра атомов. Это обеспечивает высокую химическую реактивность металлов и их способность образовывать ионы положительного заряда.
Электронная оболочка также влияет на светооптические свойства металлов. Например, благодаря свободному движению электронов в металлической оболочке, металлы обладают способностью отражать свет, что придает им металлический блеск и яркость.
Атомные радиусы и их зависимость от периода
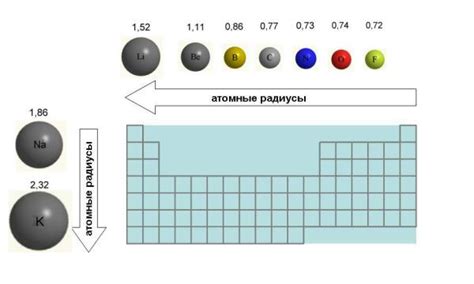
Атомный радиус представляет собой половину расстояния между ядрами двух смежных атомов. Он является важной характеристикой атома, поскольку имеет прямое влияние на его химические и физические свойства. Атомные радиусы металлов варьируются по всему периодическому столу и могут быть использованы для анализа структуры и свойств вещества.
Зависимость атомных радиусов металлов от периода проявляется в том, что внутри каждого периода атомные радиусы металлов увеличиваются при движении отлево направо. Это связано с эффектом экранирования, когда внешние электроны внутренних энергетических уровней отталкивают внешние электроны, снижая электростатическое притяжение между электронами и ядром. В результате атомные радиусы металлов увеличиваются, поскольку электроны занимают большую область пространства.
Зависимость атомных радиусов металлов от периода также проявляется в том, что в каждом последующем периоде энергетический уровень, на котором находятся внешние электроны, увеличивается. Это означает, что эти электроны находятся на более удаленной от ядра области и, следовательно, атомные радиусы металлов увеличиваются.
Таким образом, за счет эффекта экранирования и увеличения удаленности внешних электронов от ядра, атомные радиусы металлов увеличиваются при движении отлево направо внутри каждого периода периодической системы. Эта зависимость является важным фактором, определяющим химические и физические свойства металлов и может быть использована для анализа и предсказания их поведения в реакциях и соединениях.
Изотопы и стабильность атомов металлов

Изотопы - это разновидности атомов одного и того же элемента, которые отличаются числом нейтронов в ядре. У атомов металлов часто встречаются несколько изотопов, что влияет на их стабильность и химические свойства.
Стабильность атомов металлов зависит от соотношения протонов и нейтронов в ядре. Если это соотношение оптимально, атом считается стабильным. Однако, некоторые изотопы металлов могут быть нестабильными и распадаться со временем, испуская радиацию.
Стабильные атомы металлов имеют больше протонов, чем нейтронов в ядре, поэтому они обычно находятся в основной форме элемента. Нестабильные изотопы, с другой стороны, имеют большее количество нейтронов, что делает их более подверженными ядерному распаду.
Изотопы металлов могут иметь различные полезные свойства. Например, некоторые изотопы металлов могут быть использованы в медицине для диагностики и лечения различных заболеваний. Также, некоторые изотопы металлов могут использоваться в ядерной энергетике или для создания новых материалов с уникальными свойствами.
Изучение изотопов металлов является важной областью науки, которая помогает понять особенности химических реакций, происходящих с этими элементами, а также применения изотопов в различных отраслях науки и промышленности.
Электронное строение и химические свойства

Электронное строение атомов металлов отличается от других элементов в периодической таблице. Они имеют относительно небольшое количество валентных электронов во внешней электронной оболочке, обычно от одного до трех. Это делает металлы склонными к образованию положительных ионов.
При химических реакциях атомы металлов отдают свои валентные электроны, чтобы образовать катионы. Это связано с тем, что металлы обычно имеют малою электроотрицательность и большой радиус атома, что позволяет электронам легко покидать атом и образовывать ионы положительной заряды.
Химические свойства атомов металлов определяют их способность к проводимости электричества и тепла. Это связано с наличием свободных электронов, которые осуществляют передачу заряда и энергии в металлической решетке.
Металлы также имеют способность образовывать сплавы, которые позволяют им обладать различными свойствами и использоваться в разных областях. Сплавы металлов могут быть более прочными, иметь особые магнитные свойства или быть устойчивыми к коррозии.
Особенности электронного строения и химических свойств атомов металлов делают их важными и необходимыми в различных отраслях промышленности и технологии, от строительства до электроники и металлургии. Изучение и понимание этих особенностей позволяет нам оптимизировать и улучшить использование металлов в нашей жизни и развитии нашей цивилизации.
Ионизационная энергия и ее влияние на реакции
Ионизационная энергия - это количество энергии, необходимое для удаления одного электрона из атома. Для металлов она обычно составляет несколько электрон-вольт (эВ), что говорит о низкой энергии, необходимой для удаления электрона.
Влияние ионизационной энергии на реакции
- Реакции окисления-восстановления. Низкая ионизационная энергия металлов обуславливает их способность отдавать электроны и образовывать катионы. Такие металлы легко подвергаются окислению, что приводит к образованию химических соединений с отрицательно заряженными атомами или группами (анионы).
- Взаимодействие с кислородом. Металлы с низкой ионизационной энергией образуют окисленные соединения при взаимодействии с кислородом. Это приводит к образованию оксидов, которые часто являются основаниями. Например, натрий образует оксид натрия (Na2O) при реакции с кислородом.
- Протекание реакций. Ионизационная энергия металлов также может влиять на скорость протекания реакций. Металлы с низкой ионизационной энергией имеют большую склонность к реакциям, поскольку процесс удаления электрона происходит легко. Поэтому они часто используются в качестве катализаторов.
| Металл | Ионизационная энергия (эВ) |
|---|---|
| Литий | 5,39 |
| Натрий | 5,14 |
| Калий | 4,34 |
| Магний | 7,65 |
Как видно из примера, ионизационная энергия металлов обычно невысокая, что позволяет им проявлять особые свойства в химических реакциях. Исходя из этих особенностей, металлы находят широкое применение в различных отраслях промышленности и технологии.
Металлическая связь и ее значения в природе

Металлическая связь - это особый тип химической связи, присущий атомам металлов. Она образуется при взаимодействии между свободными электронами и положительно заряженными ионами металлической решетки.
Одной из главных особенностей металлической связи является подвижность электронов. Электроны в металлах могут свободно перемещаться по всему объему материала, что обеспечивает хорошую электропроводность металлов. Благодаря этому свойству металлы широко используются в электронике и электротехнике.
Кроме того, металлическая связь обеспечивает особую прочность и пластичность металлов. Силы притяжения между атомами металлической решетки оказываются слабее, чем силы ковалентной или ионной связи, что позволяет атомам легко перемещаться друг относительно друга без нарушения структуры материала.
Еще одним важным свойством металлической связи является способность металлов к теплопроводности. Благодаря свободному движению электронов, тепловая энергия может передаваться по всему объему металла, что позволяет равномерно распределить тепло и предотвратить его местное скопление.
В заключение, металлическая связь обеспечивает атомам металлов особые свойства, такие как электропроводность, прочность, пластичность и теплопроводность. Эти свойства делают металлы универсальными материалами для различных областей науки и техники.
Вопрос-ответ

