Периодическая система химических элементов объединяет все известные элементы в удобную систему, основанную на их свойствах и химической активности. Каждый период в периодической таблице состоит из группы элементов, расположенных по горизонтали и обладающих сходными свойствами. В одном периоде могут быть как металлы, так и неметаллы, и их атомы обладают рядом отличий.
Атомы металлов в одном периоде часто имеют меньшую электроотрицательность и большую атомную массу по сравнению с атомами неметаллов. Металлы обычно имеют один или два электрона в внешней электронной оболочке, что делает их более склонными к отдаче электронов и образованию положительных ионов. Это обуславливает их химическую реактивность и способность образовывать простые и ионные соединения.
Неметаллы, наоборот, обычно имеют высокую электроотрицательность и меньшую атомную массу. Они чаще всего обладают 4-8 электронами во внешней электронной оболочке, что делает их более склонными к приобретению электронов и образованию отрицательных ионов. Неметаллы проявляют химическую активность в реакциях, сопряженных с приобретением или обменом электронов, и способны образовывать ковалентные соединения.
Металлы и неметаллы

Металлы и неметаллы - это две основные группы химических элементов. Они имеют различные физические и химические свойства, которые определяют их поведение и реакции в химических процессах.
Металлы, такие как железо, алюминий и медь, обладают высокой теплопроводностью и электропроводностью. Они обычно являются твердыми при комнатной температуре, хотя некоторые металлы, такие как ртуть, могут быть жидкими. Металлы имеют блестящую поверхность и обычно способны проводить ток и тепло с легкостью.
Неметаллы, такие как кислород, сера и хлор, обладают обратными характеристиками. Они обычно являются газообразными или твердыми в виде хрупких материалов. Неметаллы плохо проводят электричество и тепло, и они не обладают блестящей поверхностью. Вместо этого они обычно образуют области с высокой электронной плотностью, что делает их эффективными для химических реакций.
Одно из отличий между металлами и неметаллами в одном периоде таблицы элементов Менделеева - это электроотрицательность. Металлы имеют низкую электроотрицательность, что означает, что они склонны отдавать электроны в химических реакциях. Неметаллы, напротив, обычно имеют высокую электроотрицательность и склонны принимать или разделять электроны.
Несмотря на все эти различия, металлы и неметаллы часто взаимодействуют друг с другом в химических реакциях, образуя соединения, известные как соли или оксиды. Эта химическая взаимосвязь между металлами и неметаллами играет важную роль во многих процессах и является основой для создания различных материалов и соединений, которые используются в промышленности и повседневной жизни.
Периодическая система элементов

Периодическая система элементов - это удобный способ классификации химических элементов. Она представляет собой таблицу, в которой элементы расположены в порядке возрастания атомного номера, а также группированы по их химическим свойствам.
В периодической системе элементов элементы разделены на металлы и неметаллы. Металлы обладают свойствами, такими как высокая термическая и электрическая проводимость, блеск, гибкость и хорошая пластичность. Неметаллы, напротив, обладают низкой электрической и тепловой проводимостью и могут быть хрупкими.
В одном периоде периодической системы элементов металлы и неметаллы имеют различные химические и физические свойства. Например, металлы в одном периоде обычно имеют более высокие температуры плавления и кипения, чем неметаллы. Кроме того, металлы обычно образуют положительные ионы, тогда как неметаллы образуют отрицательные ионы или соединения с водородом.
Однако, не все элементы жестко соответствуют классификации металлов и неметаллов. Некоторые элементы, называемые полуметаллами или металлоидами, обладают свойствами как металлов, так и неметаллов, и могут иметь различные химические и физические свойства.
Расположение в периоде

Металлы и неметаллы расположены в периоде различным образом. Обычно металлы занимают левую часть периода, а неметаллы - правую. Однако, есть исключения, когда некоторые металлы расположены справа от неметаллов.
Расположение в периоде имеет связь с электронной конфигурацией атомов. Металлы обычно имеют малое количество внешних электронов и стремятся отдать эти электроны для образования положительных ионов. Неметаллы, напротив, имеют большое количество внешних электронов и стремятся принять электроны для образования отрицательных ионов.
Также следует отметить, что некоторые элементы в периоде могут иметь свойства как металлов, так и неметаллов. Эти элементы называются металлоидами или полуметаллами. Они располагаются между металлами и неметаллами и обладают как металлическими, так и неметаллическими свойствами. Примерами металлоидов являются кремний, германий и арсений.
Таким образом, расположение металлов и неметаллов в периоде зависит от их электронной конфигурации и их способности отдавать или принимать электроны. Оно также позволяет отделить металлы от неметаллов и определить свойства элементов в периоде.
Атомный радиус

Атомный радиус - характеристика размеров атома. Он определяется расстоянием от центра ядра до наружной оболочки электронов. Размер атома связан с его электронной структурой, а также с количеством электронных оболочек и их заполненностью.
В периоде элементов атомный радиус металлов обычно больше, чем у неметаллов. Это связано с тем, что у металлов наружные электронные оболочки слабо удерживаются ядром, и атомы этих элементов имеют большие размеры. Неметаллы, напротив, имеют сильную связь между ядром и наружными электронами, поэтому атомы неметаллов обычно имеют меньший радиус.
Радиус атомов металлов неоднороден в одном периоде. Например, во втором периоде атомный радиус кислорода (неметалла) меньше, чем у всех металлов данного периода (лития, гелия, бериллия, бора и т.д.). Это объясняется тем, что у кислорода больше зарядовых электронов, чем у металлов, и эти электроны притягиваются к ядру сильнее, что уменьшает размеры атома.
Атомный радиус является важной характеристикой элементов, так как от него зависит множество свойств вещества, таких как электропроводность, химическая активность, теплопроводность и др.
Ионные радиусы
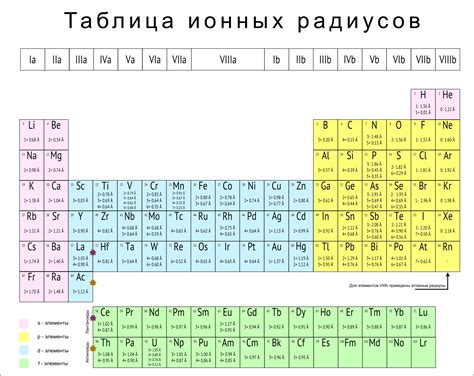
Одним из важных параметров атомов металлов и неметаллов в периоде является ионный радиус. Ионный радиус представляет собой расстояние от центра ядра атома до внешней границы его электронной оболочки.
У металлов и неметаллов в одном периоде ионные радиусы обычно различаются. Металлы имеют малые ионные радиусы, так как они имеют тенденцию отдавать электроны и образовывать положительные ионы (катионы). Неметаллы, напротив, имеют большие ионные радиусы, так как они имеют тенденцию принимать электроны и образовывать отрицательные ионы (анионы).
Важно отметить, что ионные радиусы металлов и неметаллов в одном периоде увеличиваются отлево направо. Это связано с тем, что с увеличением атомного номера в периоде увеличивается количество электронов в атоме, что приводит к увеличению радиуса электронной оболочки.
Имея информацию об ионных радиусах металлов и неметаллов в одном периоде, можно сделать вывод о различиях в их химических свойствах. Металлы, имея малый ионный радиус, обычно проявляют металлические свойства, такие как отличная проводимость электричества и тепла, пластичность и блеск. Неметаллы, с большими ионными радиусами, обычно обладают неметаллическими свойствами, такими как плохая проводимость электричества и тепла, хрупкость и отсутствие блеска.
Химические свойства

Атомы металлов и неметаллов в одном периоде имеют различные химические свойства, что обусловлено их разной природой и строением электронной оболочки.
Металлы, обладая малым электроотрицательностью, имеют склонность отдавать электроны, образуя положительные ионы, которые обычно обладают химической активностью. Неметаллы, напротив, имеют высокую электроотрицательность и склонность к приобретению электронов, образуя отрицательные ионы. Это придает им характерную химическую активность.
Металлы образуют основные оксиды, которые вступают в реакцию с водой, образуя щелочи. Они также образуют соли с неметаллами и кислотами. Неметаллы, в свою очередь, образуют кислотные оксиды, которые реагируют с водой, образуя кислоты. Они также образуют соли с металлами.
Металлы обладают высокой теплопроводностью и электропроводностью из-за наличия свободных электронов в их структуре. Неметаллы, наоборот, обычно являются плохими проводниками тепла и электричества.
Также следует отметить, что металлы обладают высокой пластичностью и свариваемостью, в то время как неметаллы обычно хрупкие и не обладают этими свойствами.
Вопрос-ответ

Какие отличия между атомами металлов и неметаллов в одном периоде?
Атомы металлов и неметаллов в одном периоде отличаются по ряду параметров. Атомы металлов имеют большую атомную радиус и меньшую электроотрицательность по сравнению с атомами неметаллов. Кроме того, атомы металлов имеют тенденцию отдавать электроны, образуя положительно заряженные ионы, в то время как атомы неметаллов имеют тенденцию принимать электроны, образуя отрицательно заряженные ионы.
Какие свойства отличают атомы металлов от атомов неметаллов в одном периоде?
Атомы металлов и неметаллов в одном периоде обладают разными свойствами. Атомы металлов обычно имеют низкую электроотрицательность, высокую термическую и электрическую проводимость, а также высокую плотность. Они могут образовывать ионы с положительным зарядом и обладают металлическим блеском. С другой стороны, атомы неметаллов имеют высокую электроотрицательность, низкую термическую и электрическую проводимость, а также низкую плотность. Они могут образовывать ионы с отрицательным зарядом и не обладают металлическим блеском.
