Валентные электроны играют важную роль в химических реакциях и определяют химические свойства атомов. Они находятся на самом наружном энергетическом уровне атома и отвечают за его возможность образования связей с другими атомами. Влияние щелочных металлов на количество валентных электронов является одной из ключевых характеристик этих элементов.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, обладают свойством образовывать ион положительного заряда, лишаясь одного электрона. Это обусловлено тем, что наружный энергетический уровень атома щелочного металла содержит только один валентный электрон. Потеря этого электрона позволяет атому щелочного металла приобрести стабильную октетную конфигурацию и стать ионом с положительным зарядом.
В таком состоянии ионы щелочных металлов обладают высокой реактивностью, так как стремятся восстановить недостающий электронный октет. Они способны активно взаимодействовать с другими элементами, образуя ионные связи, водородные связи или ковалентные связи. Это обусловлено возможностью ионам щелочных металлов обеспечить электронный октет с помощью электронной пары, присоединенной извне.
Однако, с увеличением атомного номера щелочных металлов, количество валентных электронов не увеличивается. Вместе с этим увеличивается количество энергетических уровней и субуровней, что влияет на структуру электронной оболочки. Это, в свою очередь, влияет на химические свойства щелочных металлов и их способность образовывать химические связи с другими элементами.

Влияние щелочных металлов на количество валентных электронов
Щелочные металлы - это группа элементов, которые характеризуются высокой химической активностью и низкой электронной аффинностью. Эти металлы входят в первую группу периодической системы и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Валентные электроны - это электроны, находящиеся на внешнем энергетическом уровне атома. Количество валентных электронов в щелочных металлах соответствует их порядковому номеру в периодической системе. Например, у лития один валентный электрон, у натрия два, у калия три и так далее.
Щелочные металлы обладают способностью образовывать однозарядные ионы, отдавая свои валентные электроны. Это связано с их малым размером и низкой электронной аффинностью. Так, литий образует ион Li+, отдавая свой единственный валентный электрон, а натрий образует ион Na+, отдавая два валентных электрона.
Влияние щелочных металлов на количество валентных электронов определяется их химическими свойствами и электронной структурой. Увеличение порядкового номера в группе ведет к увеличению количества валентных электронов и, как следствие, к увеличению химической активности металлов. Это связано с увеличением энергии внешнего энергетического уровня и возможностью образования более стабильных соединений.
Открытие и история исследования

Исследование влияния щелочных металлов на количество валентных электронов - это важный аспект изучения химических свойств элементов.
Первый щелочной металл, литий, был открыт в 1817 году шведским химиком Йонасом Й. Берцелиусом. Он обнаружил, что литий образует щелочную соль и реагирует с водой, образуя щелочной раствор. Это открытие стало отправной точкой для исследования других элементов щелочной группы.
Исследователи обнаружили, что щелочные металлы, такие как натрий, калий, рубидий и цезий, имеют общие химические свойства. Они образуют щелочные соли, легко реагируют с водой и образуют щелочные растворы. Щелочные металлы также обладают низкой плотностью и невысокими температурами плавления и кипения.
Каждый щелочный металл имеет определенное количество валентных электронов, определяющих его химические свойства. Литий имеет одну валентную электрон, натрий - одну, калий - одну, рубидий - одну, цезий - одну, а франций - также одну валентную электрон. Это означает, что щелочные металлы готовы передавать или принимать одну электрону в химических реакциях, чтобы достичь стабильной октаэдральной структуры.
Литий: уникальные свойства и количество валентных электронов

Литий – элемент химической таблицы, который обладает уникальными свойствами. Он является самым легким металлом и имеет наименьшую плотность. Кроме того, литий является очень реактивным элементом и легко вступает в химические реакции.
Уникальность лития заключается также в его валентности. Литий имеет один валентный электрон во внешней электронной оболочке. Валентность – это количество свободных электронов, которые способны участвовать в химических реакциях. У лития всего один валентный электрон, что делает его очень активным и способным образовывать химические соединения.
Щелочные металлы, включая литий, легко отдают свой валентный электрон другим элементам, образуя ионы с положительным зарядом. Например, литий с легкостью образует ион Li+, отдавая свой единственный валентный электрон. Такие ионы обладают большой химической активностью и используются в различных сферах, включая электрохимию и фармацевтику.
Натрий: применение и электронная конфигурация
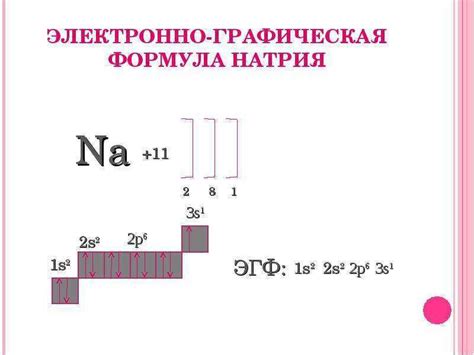
Натрий (Na) является щелочным металлом, расположенным во второй группе периодической таблицы. Он имеет атомный номер 11 и относится к семейству щелочных металлов, включая литий, калий, рубидий и цезий. Натрий обладает рядом уникальных свойств и широко применяется в различных областях.
Натрий имеет электронную конфигурацию [Ne]3s1. Это означает, что у него есть одна валентная электронная оболочка, содержащая одну электронную пару в s-орбитале. Благодаря этому, натрий обладает высокой активностью в химических реакциях и легко образует ионы Na+. Потеря электрона позволяет натрию получить стабильную октетную конфигурацию, подобно инертным газам.
Применение натрия широко в различных сферах. В химической промышленности он используется для производства соли, щелочей и луга. Натрий также находит широкое применение в пищевой промышленности, где его соли используются как добавки в пищу и консерванты для улучшения вкусовых качеств и продолжительности хранения продуктов.
В медицинской отрасли натрий играет важную роль, так как он является одним из основных ионов в организме. Благодаря натрию поддерживается баланс воды и электролитов в организме, он играет роль в нервных импульсах и сокращении мышц. Натрий также используется в батареях, стекловидном производстве и даже в ядерной энергетике.
Калий: влияние на сферы применения и химические свойства
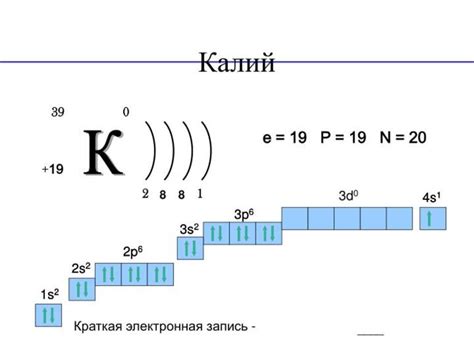
Калий – это щелочной металл, который играет важную роль во множестве сфер применения. Он широко используется в сельском хозяйстве, фармацевтической промышленности, производстве удобрений и многих других областях.
Одним из наиболее важных химических свойств калия является его способность вступать в реакцию с водой. При контакте с водой калий реагирует с выделением водорода и образованием щелочного раствора. Это свойство делает калий полезным для использования в производстве щелочных и щелочно-металлических соединений.
Калий также является важным элементом в питании растений. Он входит в состав многих минеральных удобрений, так как способствует росту корней, улучшает усвояемость питательных веществ и повышает урожайность. Благодаря этому свойству, калий является неотъемлемой частью сельского хозяйства.
В фармацевтической промышленности калий применяется в производстве многих лекарственных препаратов. Он помогает в регулировании водного и электролитного баланса в организме, а также является необходимым элементом для нормального функционирования нервной системы и работы сердца.
Все эти факторы делают калий очень ценным элементом в различных сферах применения. Благодаря его химическим свойствам и способностям, калий играет важную роль в сельском хозяйстве, фармацевтике и других областях, принося пользу человечеству и содействуя нашему благополучию.
Рубидий: особенности электронного строения и его применение
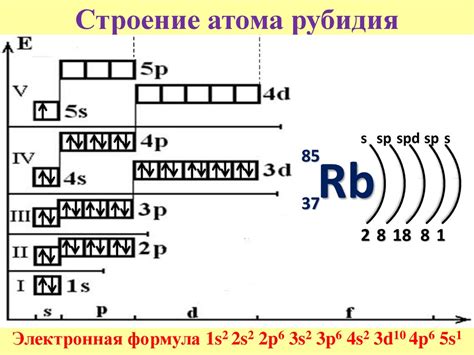
Рубидий - щелочной металл, находящийся в периодической таблице после калия и обладающий атомным номером 37. Его электронная конфигурация состоит из 37 электронов, распределенных по энергетическим уровням и орбиталям. Внешний электронный уровень рубидия содержит один свободный электрон в s-орбитали, из-за чего элемент обладает интересными свойствами.
Свободный электрон на внешнем электронном уровне делает рубидий очень реактивным, особенно в реакциях со средами, содержащими электроотрицательные элементы. Также рубидий обладает способностью образовывать ионы, с распределением электронов Rb+. Из-за своей химической реактивности и способности образовывать ионы рубидий находит применение в различных областях.
Одно из основных применений рубидия - в производстве тепловых электроагрегатов, где его способность быть образцом для электродов и создавать разность потенциалов используется для конверсии тепловой энергии в электрическую. Кроме того, рубидий применяется в батареях, использующих технологию сухих элементов, где служит анодом.
Элегантное черное вещество рубидий-акетат используется в процессе органического синтеза для получения сложных соединений и каталитических реакций. Кроме того, рубидий широко применяется в физике и науке для создания искусственных атомных часов и в оптике для создания экранов высокой разрешающей способности, исходя из сильной атомной спектроскопии рубидия.
Таким образом, рубидий благодаря своей электронной структуре и реактивности находит широкое применение в различных областях науки и техники, от производства электроагрегатов до органического синтеза и оптики.
Цезий и франций: свойства и применение валентных электронов

Цезий и франций - это два последних элемента в группе щелочных металлов и обладают уникальными свойствами. Одним из интересных аспектов данных элементов является их влияние на количество валентных электронов.
Цезий и франций имеют по одному валентному электрону, что делает их очень реактивными. Их наиболее стабильное и биологически активное состояние - +1 окислительное состояние.
Данные элементы имеют широкое применение в различных областях, включая фотоэлементы, оптическую спектроскопию, радиационные детекторы и даже ядерные реакторы. В частности, цезий-137, радиоактивный изотоп цезия, используется в медицине для лечения рака и в промышленности для измерения толщины материалов и контроля уровня жидкостей и твердых веществ.
Франций, в свою очередь, является одним из самых редких и реактивных элементов на Земле. Его применение ограничено из-за его крайней нестабильности и короткого полупериода распада.
Таким образом, цезий и франций, благодаря наличию лишь одного валентного электрона, имеют ярко выраженную химическую активность и находят применение в различных научных и технических областях.
Вопрос-ответ

Какие щелочные металлы относятся к группе I периодической системы?
В группе I периодической системы находятся следующие щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему щелочные металлы имеют одинаковое количество валентных электронов?
У щелочных металлов одинаковое количество валентных электронов (1 электрон). Это связано с тем, что они находятся в первой группе периодической системы, что означает, что у них один валентный электрон в s-подуровне.
Как влияет увеличение атомного номера на количество валентных электронов у щелочных металлов?
С увеличением атомного номера у щелочных металлов количество валентных электронов также увеличивается. Например, литий имеет 1 валентный электрон, натрий - 1, калий - 1, рубидий - 1, цезий - 1, а франций - 1. Это связано с тем, что с увеличением атомного номера увеличивается количество электронов в оболочке, и последний электрон всегда находится в s-подуровне.
