Электродный потенциал металла - это величина, которая определяет его химическую активность в реакциях окисления и восстановления. Важно понимать, что электродный потенциал зависит от различных факторов, и одним из основных является формула Нернста. Формула Нернста используется для расчета потенциала электрода в зависимости от его концентрации, температуры и ионной активности.
Один из факторов, влияющих на величину электродного потенциала металла, - это концентрация ионов металла в растворе. Чем выше концентрация ионов, тем больше электродный потенциал. Это объясняется тем, что чем больше ионов металла в растворе, тем вероятнее их взаимодействие с электродом и возможность реакции окисления или восстановления.
Другой фактор, влияющий на электродный потенциал металла, - это температура. Возрастание температуры может привести к изменению энергии реакции и, следовательно, изменению потенциала электрода. В общем случае, с повышением температуры электродный потенциал металла снижается, но это зависит от конкретной реакции и металла.
Третий фактор, оказывающий влияние на электродный потенциал металла, - это ионная активность. Ионная активность зависит от концентрации ионов и их активности в растворе. Чем выше ионная активность, тем выше электродный потенциал металла. Формула Нернста позволяет учесть этот фактор и рассчитать точное значение потенциала электрода.
Итак, факторы, влияющие на величину электродного потенциала металла, включают концентрацию ионов металла в растворе, температуру и ионную активность. Формула Нернста является основным инструментом для расчета потенциала электрода на основе этих факторов. Понимание этих факторов и использование формулы Нернста позволяют более точно предсказывать и контролировать химические реакции соучастия металлов.
Факторы, влияющие на электродный потенциал металла:

1. Химический состав металла: Электродный потенциал металла зависит от его химического состава. Различные металлы имеют разное количество электронов в своих внешних энергетических оболочках, что влияет на их способность отдавать или принимать электроны при реакциях окисления или восстановления. Таким образом, химический состав металла определяет его электродный потенциал.
2. Раствор ионов металла: Электродный потенциал металла также зависит от характеристик раствора, в котором находятся его ионы. Концентрация ионов, pH раствора, наличие других реагентов и температура могут повлиять на потенциал металла. Например, изменение pH раствора может изменить ионизацию металла и его способность реагировать с электродами.
3. Температура: Температура оказывает влияние на электродный потенциал металла. При повышении температуры обычно происходит увеличение потенциала металла, так как тепловой энергией увеличивается движение электронов и их способность переходить через границу раздела с раствором. В то же время, некоторые металлы могут иметь обратную зависимость между электродным потенциалом и температурой.
4. Поверхность металла: Поверхность металла может влиять на его электродный потенциал. Качество поверхности, наличие окисления, насыщенность различными реагентами и другие факторы могут изменять способность металла отдавать или принимать электроны. Например, защитное покрытие на поверхности металла может снизить его тенденцию к окислению и, следовательно, его электродный потенциал.
5. Внешние условия: Внешние условия, такие как давление, влажность, наличие других реагентов и т. д., также могут влиять на электродный потенциал металла. Например, повышенное давление может увеличить электродный потенциал, а наличие других реагентов может вызвать реакции с металлом и изменить его потенциал.
Все эти факторы могут взаимодействовать и оказывать комбинированное влияние на электродный потенциал металла. Поэтому при изучении или использовании металлов в электрохимических процессах необходимо учитывать все эти факторы и принимать их во внимание для достижения оптимальных результатов.
Химический состав
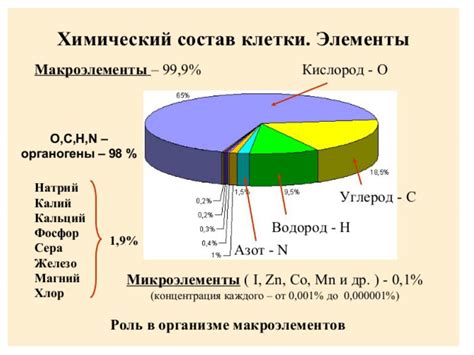
Химический состав влияет на величину электродного потенциала металла и его способность участвовать в реакциях окисления и восстановления. Различные металлы имеют разные химические элементы, атомы которых составляют их структуру.
Наиболее важный химический фактор, влияющий на электродный потенциал металла, это его степень окисления. Чем выше степень окисления, тем выше будет электродный потенциал металла. Например, у железа в двух степенях окисления Fe2+ и Fe3+ электродный потенциал различается.
Также химический состав может включать примеси и легирующие элементы. Примеси могут существенно изменить электродный потенциал металла. Например, легирование железа с хромом повышает его устойчивость к коррозии.
Таблица химического состава различных металлов позволяет сравнивать и анализировать их электродные потенциалы и определить их реакционную способность. Важно помнить, что химический состав металла может меняться в зависимости от условий окружающей среды, что также может влиять на его электродный потенциал.
Месторасположение в электрохимическом ряде

Месторасположение металла в электрохимическом ряде является одним из факторов, влияющих на величину его электродного потенциала. Электрохимический ряд представляет собой таблицу, где металлы упорядочены по их способности вступать в реакцию с растворами электролитов. Возможность перехода электрона от одного металла к другому определяет их положение в ряду.
Электрохимический ряд позволяет сравнивать активность металлов с точки зрения их реакционной способности. Металлы, находящиеся в верхней части ряда, обладают большей активностью и легко окисляются, образуя положительный ион и электроны. В то же время, металлы, находящиеся в нижней части ряда, менее активны и имеют большую тенденцию к восстановлению положительного иона.
Величина электродного потенциала металла зависит от его положения в электрохимическом ряде. Металлы, находящиеся в верхней части ряда, имеют более положительный электродный потенциал, то есть легче отдают электроны. Металлы, находящиеся в нижней части ряда, имеют более отрицательный электродный потенциал, то есть труднее отдать электроны.
Месторасположение металла в электрохимическом ряде является важным фактором, устанавливающим его реакционную способность и способность участвовать в электрохимических процессах. Знание положения металла в ряду помогает предсказывать его взаимодействия с другими веществами и использовать его в различных электрохимических приложениях, таких как гальванические элементы и электролиз.
Физические свойства

Физические свойства металлов играют важную роль в определении их электродного потенциала, который является мерой способности металла вступать в реакции окисления или восстановления.
Одним из физических свойств металла, влияющих на его электродный потенциал, является его электропроводность. Чем выше электропроводность металла, тем легче для него передавать электроны и тем выше его электродный потенциал.
Еще одним физическим свойством, влияющим на электродный потенциал металла, является его плотность. Металлы с более высокой плотностью обычно имеют большую способность вступать в реакции окисления и восстановления, и, следовательно, более высокий электродный потенциал.
Форма и поверхность металла также могут влиять на его электродный потенциал. Металлы с большей поверхностью имеют более высокий электродный потенциал, так как большая поверхность обеспечивает больше мест для происходящих реакций окисления и восстановления.
Однако необходимо отметить, что физические свойства металла не являются единственными факторами, влияющими на его электродный потенциал. Химические особенности металла, внешние условия, такие как температура и давление, также могут оказывать значительное влияние на электродный потенциал металла.
Концентрация ионов
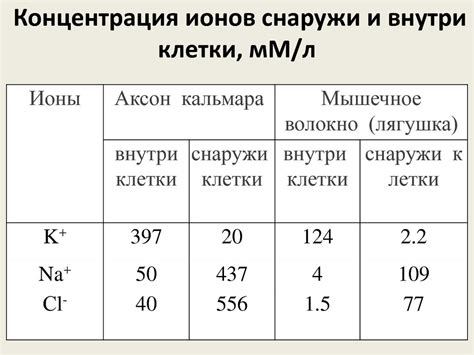
Концентрация ионов в растворе является важным фактором, влияющим на величину электродного потенциала металла. Согласно формуле Нернста, электродный потенциал зависит от разности концентраций ионов металла на поверхности электрода и в растворе. Чем больше концентрация ионов на поверхности электрода, тем больше будет электродный потенциал металла.
Таким образом, изменение концентрации ионов может привести к изменению электродного потенциала металла. Например, если концентрация ионов металла в растворе увеличивается, то на поверхности электрода также будет больше ионов. Это может привести к увеличению электродного потенциала металла.
Обратно, если концентрация ионов уменьшается, то на поверхность электрода будет поступать меньше ионов, что может привести к уменьшению электродного потенциала металла. Таким образом, изменение концентрации ионов в растворе может вызывать изменение электродного потенциала металла в системе.
Важно также отметить, что концентрация ионов может быть разной в разных точках раствора. Поэтому для точного определения величины электродного потенциала металла необходимо учитывать концентрацию ионов как на поверхности электрода, так и в растворе на различных участках системы.
Температура
Температура является одним из факторов, влияющих на величину электродного потенциала металла. Известно, что при повышении температуры величина электродного потенциала уменьшается. Это связано с изменениями реакций на поверхности металла и скоростью протекания электрохимических процессов.
Тепловое движение молекул вещества при повышении температуры приводит к увеличению активности частиц, а следовательно, к увеличению их коллизий с электронами. Это приводит к увеличению скорости автоокисления металла, что снижает его электродный потенциал. Также повышение температуры может способствовать активации других электрохимических процессов, которые могут влиять на электродный потенциал металла.
Для описания зависимости электродного потенциала от температуры применяется формула Нернста:
E = E° - (RT/nF) * ln(Q)
Где E - электродный потенциал, E° - стандартный электродный потенциал, R - универсальная газовая постоянная, T - абсолютная температура, n - количество электронов, участвующих в реакции, F - постоянная Фарадея, а Q - активность реагентов в растворе.
Таким образом, температура является важным фактором, который может изменять электродный потенциал металла и влиять на электрохимические процессы, происходящие на его поверхности.
Влияние растворителя
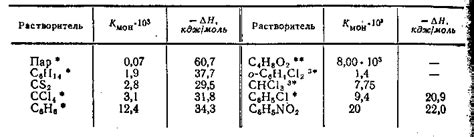
Растворитель является одним из факторов, оказывающих влияние на величину электродного потенциала металла. Растворитель – это вещество, в котором растворяется металл или его ион. Зависимость электродного потенциала от растворителя выражается формулой Нернста:
E = E0 + (0.0592/n) * log([Me]/[M])
- E - электродный потенциал металла;
- E0 - стандартный потенциал;
- n - количество электронов, участвующих в электродном процессе;
- [Me] - активность иона металла в растворе;
- [M] - активность металла.
Из формулы видно, что электродный потенциал металла зависит от значения активности ионов металла и их концентрации в растворе. Разные растворители имеют разную способность растворять металлы, поэтому они влияют на значения электродного потенциала.
Например, если металл растворяется в одном растворителе лучше, чем в другом, то его электродный потенциал будет выше в первом случае. Это связано с различной способностью растворителя образовывать с ионами металла комплексы и другие химические соединения.
Также растворитель может влиять на электродный потенциал металла через изменение параметров реакции, например, изменение pH раствора. Реакция окисления или восстановления металла может протекать с разной скоростью при разных значениях pH, что также влияет на электродный потенциал.
Величина активности

Величина активности – это параметр, который характеризует интенсивность химического процесса, включающего металл. Он определяет скорость реакции окисления или восстановления металла и влияет на его электродный потенциал.
Активность металла зависит от нескольких факторов, включая его концентрацию, температуру и окружающую среду. Чем выше концентрация металла, тем больше его активность и, соответственно, его электродный потенциал.
Температура также влияет на активность металла. При повышении температуры активность металла увеличивается, что связано с повышением скорости химических реакций. При низких температурах активность металла может быть незначительной или отсутствовать вовсе.
Окружающая среда также оказывает влияние на активность металла. Некоторые среды могут активировать металл, ускоряя химические реакции с его участием. Другие среды могут подавлять активность металла, что может привести к его коррозии или пассивации.
Таким образом, величина активности является значимым фактором, определяющим электродный потенциал металла. Понимание этого параметра позволяет более точно предсказывать и контролировать химические процессы, происходящие в системах, содержащих металлы.
Формула Нернста

Формула Нернста является основным инструментом для расчета электродного потенциала металлов. Она определяет зависимость электродного потенциала от концентрации ионов раствора, в котором находится металл. Формула была разработана немецким физико-химиком Вальтером Нернстом в конце XIX века.
Согласно формуле Нернста, электродный потенциал (E) металла в растворе определяется выражением:
E = E0 + (RT/nF) * ln([катион]/[анион])
где:
- E0 - стандартный электродный потенциал металла;
- R - универсальная газовая постоянная;
- T - абсолютная температура;
- n - число электронов, участвующих в реакции;
- F - постоянная Фарадея;
- [катион] и [анион] - концентрации соответствующих ионов в растворе.
Формула Нернста позволяет предсказывать изменение электродного потенциала металла при изменении концентрации ионов в растворе. Также по этой формуле можно расчитать стандартный электродный потенциал металла, если известны значения концентрации ионов в растворе.
Вопрос-ответ

Какая формула описывает зависимость между электродным потенциалом металла и его концентрацией?
Зависимость между электродным потенциалом металла и его концентрацией описывается формулой Нернста: E = E0 - (RT/nF) ln([Mn+]/[M]), где E - электродный потенциал, E0 - стандартный электродный потенциал, R - универсальная газовая постоянная, T - абсолютная температура, n - число электронов переносимых в реакции, F - постоянная Фарадея, [Mn+] - концентрация металлического иона, [M] - концентрация металла.
Какие факторы влияют на величину электродного потенциала металла?
На величину электродного потенциала металла влияют ряд факторов, включая: химические свойства металла, концентрация металлических ионов в растворе, температура, давление, pH среды, наличие других веществ в растворе, тип ионов, соотношение окислительно-восстановительных систем, и другие. Все эти факторы могут изменять электродный потенциал металла и, следовательно, влиять на его реакционную активность и возможность использования в электрохимических процессах.
Каким образом формула Нернста связана с электродным потенциалом металла?
Формула Нернста связывает электродный потенциал металла с его концентрацией в растворе. Она позволяет рассчитать электродный потенциал металла с учетом влияния концентрации ионов металла. Формула Нернста описывает зависимость электродного потенциала от разности концентраций между реагирующими металлическими ионами и самим металлом. Таким образом, формула Нернста играет важную роль в определении электрохимической активности металла и его реакционной способности в различных условиях.
