Щелочные металлы - это элементы, принадлежащие первой группе периодической таблицы. В этой группе находятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом особенных свойств, которые существенно отличают их от остальных элементов.
Во-первых, щелочные металлы характеризуются высокой реактивностью. Они активно взаимодействуют с кислородом, водой и другими веществами. Например, при контакте с водой щелочные металлы быстро реагируют, образуя щелочные растворы и выделяя водород. Это свойство делает их полезными для применения в реакциях, связанных с выделением газа.
Во-вторых, щелочные металлы обладают низкой плотностью. Они являются легкими элементами, что делает их удобными для использования в различных приложениях, таких как производство легких сплавов или элементов плавучести. Низкая плотность также позволяет щелочным металлам "плавать" на поверхности воды.
В-третьих, щелочные металлы обладают высокой электропроводностью. Их ионы легко перемещаются в растворах, что делает щелочные металлы полезными в производстве ионных проводников и аккумуляторов. Кроме того, щелочные металлы обладают хорошей теплопроводностью и являются хорошими проводниками тепла.
В целом, щелочные металлы обладают рядом уникальных свойств, которые делают их ценными в различных областях науки и техники. Их реактивность, низкая плотность и высокая электропроводность делают их идеальными кандидатами для применения в различных химических реакциях, материалах и электронных устройствах.
Щелочные металлы: уникальные химические свойства

Щелочные металлы - это группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом уникальных химических свойств, которые отличают их от других элементов.
Низкая плотность и мягкость. Щелочные металлы имеют низкую плотность, что делает их легкими и мягкими. Например, литий, самый легкий из щелочных металлов, имеет плотность всего 0,53 г/см³ и может быть нарезан ножом.
Высокая реактивность. Щелочные металлы отличаются высокой реактивностью из-за своей низкой ионизационной энергии. Они легко вступают в реакцию с водой, кислородом, халогенами и другими элементами, образуя щелочные соединения.
Способность к образованию ионов. Щелочные металлы имеют одну электрон во внешней электронной оболочке, что делает их склонными к потере этого электрона и образованию положительно заряженных ионов. Это делает их хорошими ионными соединениями и электролитами.
Хорошая проводимость электричества и тепла. Щелочные металлы обладают высокой электрической и теплопроводностью благодаря своей кристаллической решетке и наличию свободных электронов.
Цветные пламена. Щелочные металлы при горении производят яркие пламена разных цветов. Например, натрий дает желтый оранжевый цвет, калий - фиолетовый, рубидий - красный.
Наличие изотопов. Все щелочные металлы имеют несколько стабильных изотопов с различным количеством нейтронов в ядре. Это позволяет использовать их в различных областях науки и техники, таких как радиоизотопная датировка и исследование ядерных реакций.
Щелочные металлы сочетают в себе уникальные химические свойства, которые делают их важными для многих областей науки и техники, а также в повседневной жизни. Их реактивность и способность к образованию ионов позволяют использовать их в производстве батарей, взрывчатых и обезвреживающих веществ. Кроме того, они широко применяются в сельском хозяйстве, медицине и фармацевтической промышленности.
Щелочные металлы: понятие и классификация

Щелочные металлы - это группа элементов периодической системы, которая включает в себя литий, натрий, калий, рубидий, цезий и франций. Они получили свое название из-за своей реактивности со щелочами, такими как щелочная сода. Щелочные металлы являются самыми легкими химическими металлами и отличаются от других элементов.
Какая-то дополнительная информация: свойства металлов (пример щелочных металлов). Подробности: перечень щелочных металлов (включают литий, натрий, калий, рубидий, цезий и франций). Отличительные свойства: легкие химические металлы, высокая реактивность со щелочами.
Щелочные металлы также классифицируются на основе их свойств и реакционной способности. Наиболее характерные свойства щелочных металлов включают низкую плотность, низкую температуру плавления и высокую реактивность. Они также обладают хорошей электропроводностью и способностью образования ионов с положительным зарядом.
Также щелочные металлы могут быть распределены по реакционной способности. Например, литий считается наименее реактивным щелочным металлом, а цезий считается наиболее реактивным. Рубидий и калий также обладают высокой реактивностью, но менее чем у цезия и лития.
В общем, щелочные металлы представляют собой уникальную группу химических элементов с определенными свойствами и реакционной способностью. Их отличительные черты делают их ценными и полезными для различных применений в науке, промышленности и технологии.
Химические свойства щелочных металлов: реакция с водой
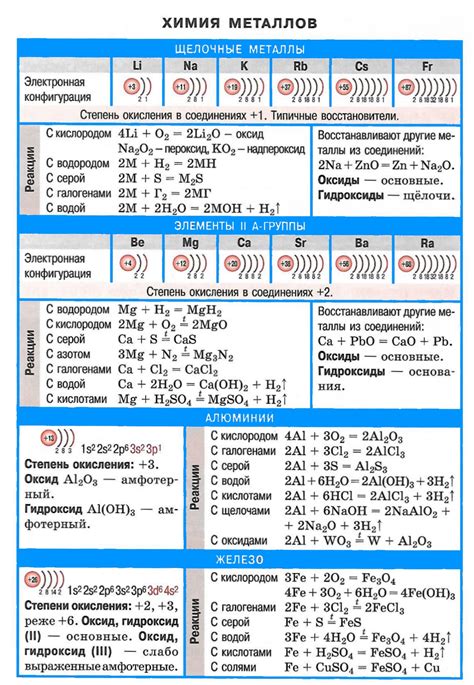
Одним из особых химических свойств щелочных металлов является их сильная реакция с водой. Как известно, щелочные металлы включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
При контакте с водой щелочные металлы быстро проявляют свою реакционность. Они активно реагируют с молекулами воды, образуя гидроксиды щелочных металлов и выделяя водород. Реакция с водой усиливается с увеличением атомного номера металла в периоде и с увеличением массы атома.
Например, литий при контакте с водой реагирует с такой силой, что может вызвать возгорание воды. Натрий также реагирует с водой, выделяя горящую металлическую шаровидную частицу и образуя гидроксид натрия (NaOH). Калий, рубидий, цезий и франций также проявляют схожие реакции с водой, образуя соответствующие гидроксиды и выделяя водород.
Эти реакции с водой щелочных металлов являются сильно экзотермическими, то есть сопровождаются выделением значительного количества тепла. Они также характеризуются высокой скоростью реакции и образованием горючих веществ, таких как водород. Поэтому при проведении экспериментов с щелочными металлами и водой необходимо соблюдать осторожность и работать соответствующими мерами безопасности.
Особенности образования и реактивности щелочных металлов

Щелочные металлы – это элементы, расположенные в первой группе периодической системы химических элементов. Они включают литий, натрий, калий, рубидий, цезий и франций. Что их особенно отличает от других элементов?
Одной из особенностей щелочных металлов является их высокая активность. Они легко реагируют с водой, кислородом и другими химическими веществами. Это связано с их низкой ионизацей энергией и способностью легко отдавать электрон. Также щелочные металлы имеют низкую энергию ионизации, что обуславливает их большую активность в химических реакциях.
Образование щелочных металлов происходит в звездах, в процессе ядерных реакций. В результате таких реакций синтезируются элементы литий, натрий, калий, рубидий, цезий и франций. После образования, щелочные металлы могут находиться в природе в свободном состоянии или в виде минералов.
Реактивность щелочных металлов обусловлена их способностью активно вступать в различные химические реакции. Они легко реагируют с водой, образуя гидроксиды, которые являются сильными щелочными растворами. Щелочные металлы также реагируют с кислородом, образуя оксиды. Они могут вступать в реакции с кислотами, а также образовывать соединения со многими другими веществами.
Физические свойства щелочных металлов: точка плавления и кипения

Щелочные металлы - это первая группа периодической системы элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Одной из особенностей щелочных металлов является их низкая точка плавления и кипения, что делает их одними из наиболее реактивных металлов.
Точка плавления - это температура, при которой твердое вещество превращается в жидкость. У щелочных металлов точка плавления достаточно низкая и снижается по мере увеличения атомного номера элемента в группе. Например, литий имеет точку плавления приблизительно 180 градусов Цельсия, а цезий - всего около 28 градусов Цельсия.
Кипение - это процесс, при котором жидкость превращается в газ. Различные щелочные металлы имеют различные точки кипения. Натрий, к примеру, кипит приблизительно при 883 градусах Цельсия, в то время как цезий может кипеть уже при комнатной температуре.
Низкая точка плавления и кипения у щелочных металлов объясняется слабыми межатомными силами, что приводит к наличию мягкой и пластичной структуры металлов. Кроме того, именно в связи с низкой температурой плавления и кипения, щелочные металлы обычно хранятся под слоем масла или специальных жидкостей для предотвращения их окисления воздухом.
Реакция щелочных металлов с кислородом и водородом

Щелочные металлы, такие как литий, натрий и калий, проявляют активность при взаимодействии с кислородом и водородом. Эти реакции - характерные свойства щелочных металлов.
Реакция щелочных металлов с кислородом происходит достаточно быстро и сопровождается выделением тепла и образованием оксидов. Например, литий при реакции с кислородом образует оксид лития (Li2O), натрий - оксид натрия (Na2O), а калий - оксид калия (K2O).
Реакция щелочных металлов с водородом также является быстрой и экзотермической. При взаимодействии с водородом щелочные металлы образуют гидриды. Например, литий образует гидрид лития (LiH), натрий - гидрид натрия (NaH), а калий - гидрид калия (KH).
Оба этих вида реакций имеют важное практическое применение. Оксиды щелочных металлов, образующиеся при реакции с кислородом, являются базами и активно используются в процессе нейтрализации кислот, а гидриды щелочных металлов, которые образуются при реакции с водородом, применяются в качестве порошка для хранения и транспортировки водорода.
Влияние щелочных металлов на биологические организмы

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в жизнедеятельности биологических организмов. Они являются неотъемлемыми компонентами клеток и выполняют множество функций, необходимых для поддержания нормальной работы организма.
Одним из главных свойств щелочных металлов является их способность образовывать ионы, которые активно взаимодействуют с другими молекулами в клетке. Например, калий и натрий участвуют в поддержании осмотического равновесия клетки и регулируют транспорт различных веществ через клеточные мембраны.
Другим важным аспектом влияния щелочных металлов на биологические организмы является их роль в передаче нервных импульсов. Калий, натрий и литий играют ключевую роль в генерации и распространении электрических сигналов в нервных клетках. Это позволяет организму контролировать множество функций, включая мышечную активность, сенсорные восприятия и регулирование сердечного ритма.
Кроме того, некоторые щелочные металлы, например литий, применяются в медицине для лечения некоторых психических расстройств, таких как биполярное расстройство и депрессия. Литий оказывает стабилизирующее действие на настроение и может снижать частоту эпизодов мании и депрессии у пациентов.
Однако, несмотря на все полезные свойства, щелочные металлы также могут быть токсичными при неправильном использовании. Высокие концентрации калия, натрия и других щелочных металлов могут вызывать нарушения в работе сердца, почек и других органов. Поэтому важно контролировать уровень этих металлов в организме и не превышать допустимые нормы при их употреблении или применении в медицинских целях.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкий спектр применения в промышленности благодаря своим уникальным свойствам.
Литий, например, широко используется в производстве аккумуляторов для электромобилей и портативных электронных устройств. Его низкая плотность и высокая энергетическая емкость делают его идеальным материалом для создания легких и мощных батарей.
Натрий встречается в большом количестве в природе, и его главное применение в промышленности связано с производством щелочей, стекла и мыла. Натриевые соединения также используются в производстве синтетических волокон и пищевых добавок.
Калий является неотъемлемым компонентом удобрений, так как он является одним из основных макроэлементов, необходимых растениям для нормального роста и развития. Калийные удобрения помогают увеличить урожайность и качество сельскохозяйственных культур, что делает их незаменимыми для современного земледелия.
Рубидий и цезий, хотя и имеют ограниченное применение, находят свое применение в различных областях, таких как оптика, электроника и ядерная энергетика. Они могут использоваться в специальных стеклах, фоточувствительных пленках и атомных реакторах.
Таким образом, щелочные металлы играют важную роль в промышленности, обеспечивая производство различных продуктов и технологий. Их уникальные свойства делают их незаменимыми материалами во многих отраслях, от энергетики до сельского хозяйства.
Щелочные металлы: проблемы безопасности и переработки

Щелочные металлы, такие как литий, натрий, калий и др., обладают рядом особенных свойств, которые делают их полезными и в то же время опасными веществами. Они являются очень реактивными элементами, что делает их незаменимыми в различных отраслях, включая металлургию, фармацевтику, электронику и другие.
Однако, их высокая реактивность также создает проблемы в плане безопасности и переработки. Щелочные металлы очень быстро реагируют с водой и воздухом, что может вызывать пожары и взрывы при неправильной обработке. Поэтому, необходимы специальные меры предосторожности при работе с этими веществами.
Кроме того, проблема переработки щелочных металлов также является актуальной. Они не могут быть просто выброшены и должны быть утилизированы или переработаны в безопасной и эффективной форме, чтобы избежать негативного влияния на окружающую среду. Это вызывает необходимость разработки различных методов и технологий для переработки этих материалов, чтобы снизить их воздействие на окружающую среду и извлечь максимальную пользу из их свойств.
В целом, щелочные металлы представляют как положительную, так и негативную сторону в сфере промышленности. Их особенные свойства делают их ценными и очень важными материалами, но требуют особой безопасности и соответствующей переработки для минимизации рисков и сохранения окружающей среды.
Вопрос-ответ

Для чего используются щелочные металлы?
Щелочные металлы, такие как литий, натрий и калий, широко используются в разных отраслях. Например, они используются для производства аккумуляторных батарей, стекла, удобрений, легких сплавов и других промышленных продуктов.
Какие особенности щелочных металлов делают их особенными?
Щелочные металлы обладают несколькими особенностями, которые делают их уникальными. Одной из основных особенностей является их мягкость и низкая температура плавления, что позволяет им быть хорошими проводниками тепла и электричества. Кроме того, они реагируют с водой, образуя гидроксиды и высвобождая водород. Также, щелочные металлы образуют стойкие и легкие сплавы с другими металлами.
В чем отличие щелочных металлов от других металлов?
Одно из главных отличий щелочных металлов от других металлов заключается в их химической активности. Щелочные металлы очень реактивны и легко реагируют с кислородом, водой и другими химическими веществами. Они также образуют стойкие и низкоплавкие сплавы с другими металлами, что делает их полезными в промышленности. Кроме того, щелочные металлы имеют низкие плотности, что делает их легкими.
Какие опасности могут сопровождать работу с щелочными металлами?
Работа с щелочными металлами может быть опасной из-за их реактивности. Они могут выделять водород и энергично реагировать с водой, что может привести к пожарам и взрывам. При контакте с водой или влажными веществами, щелочные металлы могут вызывать ожоги и раздражение кожи и слизистых оболочек. Поэтому при работе с ними необходимо соблюдать все меры безопасности и использовать специальные средства защиты.
Можно ли использовать щелочные металлы в повседневной жизни?
Да, щелочные металлы используются в повседневной жизни. Например, литий используется в производстве аккумуляторных батарей для мобильных телефонов и ноутбуков. Натрий используется для приготовления пищи, а калий содержится в пищевых добавках и удобрениях.
