Щелочные металлы - группа химических элементов, которые относятся к основным металлам и находятся в первой группе периодической системы. Простые вещества щелочных металлов представляют собой металлические элементы, имеющие высокую активность в химических реакциях.
Одной из главных особенностей щелочных металлов является их высокая реактивность с водой. При контакте с водой происходит взрывоопасная реакция, сопровождающаяся выделением водорода и образованием щелочей. Эта особенность позволяет использовать щелочные металлы в различных процессах и технологиях, например, при производстве щелочей и водорода.
Еще одной особенностью щелочных металлов является их способность образовывать стабильные соли. Щелочные металлы имеют высокую энергию ионизации, что позволяет им образовывать ионы с положительным зарядом. Эти ионы легко вступают в химические реакции и образуют стабильные соединения с отрицательно заряженными анионами, такими как хлориды, сульфаты и нитраты.
Щелочные металлы также отличаются своей способностью образовывать оксиды и пероксиды. Оксиды щелочных металлов обладают щелочными свойствами и используются в различных сферах, например, в производстве стекла и металлургии. Пероксиды щелочных металлов являются мощными окислителями и используются в химической промышленности для окислительных процессов.
В целом, щелочные металлы являются важными элементами в химической промышленности и находят применение во многих сферах жизни. Их высокая активность и способность образовывать стабильные соединения делают их незаменимыми в различных процессах и технологиях, а также позволяют использовать их в реакциях с другими элементами и соединениями.
Особенности химических свойств щелочных металлов
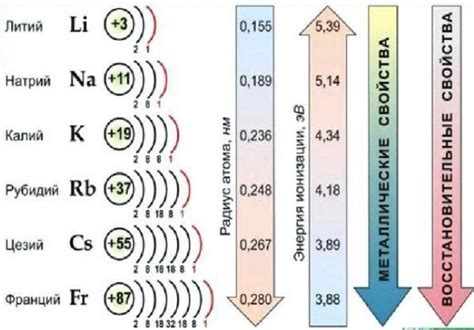
Щелочные металлы – это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом уникальных химических свойств, которые делают их незаменимыми во многих областях промышленности и науки.
Во-первых, щелочные металлы являются очень реактивными элементами. Они легко реагируют с кислородом, водой и большинством неметаллов. В результате этих реакций образуются щелочные гидроксиды, газы или соли. Кроме того, щелочные металлы способны восстанавливать вещества и образовывать сильные основания.
Во-вторых, щелочные металлы обладают высокой электроотрицательностью, что является причиной их активности и способности образовывать ионы с положительным зарядом. Это делает их хорошими каталитическими агентами и участниками многих химических реакций.
Кроме того, щелочные металлы обладают высокой электропроводностью, что делает их полезными в производстве батарей и аккумуляторов. Они также используются для создания сплавов с металлами различной степени твердости и пластичности.
Наконец, щелочные металлы встречаются в природе в виде соединений, таких как соли и руды. Они важны для многих процессов, включая производство стекла, керамики, удобрений и многих других продуктов.
Кемия щелочных металлов: общие принципы

Щелочные металлы - это группа химических элементов, включающих литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются низкой плотностью, мягкостью и низкой температурой плавления.
Щелочные металлы легко реагируют с водой, образуя гидроксиды и выделяя водород. Реактивность щелочных металлов возрастает с увеличением атомного номера в группе. Литий, наиболее легкий из щелочных металлов, наиболее активен и реагирует с водой намного быстрее, чем остальные элементы этой группы.
Щелочные металлы также образуют ионы, которые обладают положительным зарядом. Эти ионы легко сливаются с отрицательно заряженными ионами, образуя ионные соединения. Это объясняет, почему щелочные металлы реагируют с кислородом, серой и другими не металлами, в результате чего образуются щелочные оксиды или щелочные соли.
Простые вещества щелочных металлов имеют ярко выраженные щелочные свойства и широко используются в различных областях, от производства сплавов и батареек до фармацевтики и пищевой промышленности.
Электрохимические свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и т.д., имеют выраженные электрохимические свойства, которые делают их важными в области электрохимии и производстве батарей.
Во-первых, щелочные металлы отличаются высокой реактивностью. Они легко реагируют с водой, выделяя взрывчатые газы. Это связано с тем, что при контакте с водой ионизируются атомы металла, образуя катионы, а также высвобождается водородный газ.
Другое важное электрохимическое свойство щелочных металлов - способность образовывать легко ионизирующиеся катионы. В результате этого они могут служить электролитами в различных реакциях. Благодаря своей способности образовывать катионы, щелочные металлы используются в процессах электролиза и электрохимической коррозии.
Кроме того, щелочные металлы обладают высокой электродностностью, что делает их идеальными материалами для электродов в батареях и других электрических устройствах. Они легко отдают электроны и образуют ионы положительной заряды, что обеспечивает электронные потоки в электрических цепях.
Обобщая, электрохимические свойства щелочных металлов определяются их реактивностью, способностью образовывать легко ионизирующиеся катионы и высокой электродностностью. В связи с этим они широко применяются в электрохимии и производстве батарей, а также играют важную роль в электролизе и электрохимической коррозии.
Химическая активность щелочных металлов
Щелочные металлы – это элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются наиболее активными химическими элементами, так как электростатический аспект их взаимодействия с другими веществами определенно преобладает над другими факторами.
Щелочные металлы проявляют высокую реакционность воздухом. Под воздействием кислорода они быстро окисляются, образуя оксиды или пероксиды. Реакция с водой также является характерной для этих элементов: они активно распадаются на щелочь и выделяют водород. Эффект этой реакции усиливается с увеличением атомного номера элемента.
Химическая активность щелочных металлов также проявляется в реакции с галогенами. Они легко образуют соли с галогенами, например, хлоридами или бромидами. При этом реакция идет с выделением большого количества тепла, что связано с высокими стандартными энтальпиями образования этих веществ.
Щелочные металлы реагируют с несколькими веществами, образуя простые ионные соединения. Они могут образовывать соли не только с галогенами, но и с другими элементами, например, со слабыми кислотами. Формирование этих соединений происходит благодаря высокой первоначальной активности металла и высокой полярности связи между металлом и анионом.
Кроме того, щелочные металлы являются сильными редокс-агентами. Они способны образовывать полную окислительно-восстановительную реакцию с другими элементами, передавая электроны. В реакции щелочный металл окисляется, а другой элемент восстанавливается.
Таблица ниже показывает химическую активность щелочных металлов по их реакции с кислородом, водой и галогенами:
| Металл | Реакция с кислородом | Реакция с водой | Реакция с галогенами |
|---|---|---|---|
| Литий (Li) | Горит с ярким пламенем | Распадается, выделяя водород | Образует соль |
| Натрий (Na) | Горит с ярким пламенем | Распадается, выделяя водород | Образует соль |
| Калий (K) | Горит с ярким пламенем | Распадается, выделяя водород | Образует соль |
| Рубидий (Rb) | Горит с ярким пламенем | Распадается, выделяя водород | Образует соль |
| Цезий (Cs) | Горит с ярким пламенем | Распадается, выделяя водород | Образует соль |
| Франций (Fr) | Горит с ярким пламенем | Распадается, выделяя водород | Образует соль |
Физические свойства щелочных металлов

Щелочные металлы – это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть ряд характерных физических свойств, которые определяют их поведение и важны при изучении их простых веществ.
Первое физическое свойство щелочных металлов – это низкая плотность. Они являются одними из самых легких металлов. Например, литий имеет плотность всего 0,53 г/см³, что делает его наименее плотным металлом. Это свойство обусловлено их низкой атомной массой и активностью электронов, что приводит к большим межатомным расстояниям.
Второе физическое свойство – это низкая температура плавления. Щелочные металлы имеют очень низкую температуру плавления по сравнению с другими металлами. Например, натрий плавится при температуре всего 97,8°C. Это делает их легко расплавляемыми и способными к быстрому образованию сплавов.
Третье физическое свойство – это мягкость и пластичность. Щелочные металлы являются очень мягкими и пластичными. Например, кусок калия можно растянуть до тонкой проволоки или отколоть крупным куском ножом. Это свойство обусловлено слабой связью между атомами и их способностью к легкому перемещению при небольшой силе.
Таким образом, физические свойства щелочных металлов, такие как низкая плотность, низкая температура плавления, мягкость и пластичность, делают их уникальными и полезными в различных приложениях и областях химии и технологий.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каковы особенности химических свойств щелочных металлов?
Щелочные металлы обладают высокой реакционной способностью, легко образуют положительные ионы и вступают в реакцию с галогенами, кислородом и водородом. Они обладают низкой электроотрицательностью и отдают электроны в реакциях с другими элементами.
Как реагируют щелочные металлы с водой?
Щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород. Например, натрий реагирует с водой по следующему уравнению: 2Na + 2H2O → 2NaOH + H2.
Какие соединения щелочных металлов являются растворимыми в воде?
Большинство гидроксидов щелочных металлов растворимы в воде, образуя щелочные растворы. Например, гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид лития (LiOH) растворимы в воде, образуя щелочные растворы.

