Металлы являются широко распространенным классом элементов, которые обладают своеобразными химическими свойствами. Большинство металлов имеют отличительные характеристики, такие как высокая тепло- и электропроводность, блеск и металлический блеск, а также хорошая пластичность и формоизменяемость. Однако, помимо этих общих особенностей, металлы также проявляют различные уровни химической активности.
Химическая активность металла определяется его способностью вступать в химические реакции с другими элементами и соединениями. Некоторые металлы, такие как натрий, калий и литий, обладают высокой активностью и легко реагируют с водой, кислородом и другими неорганическими соединениями. Они могут вытеснять менее активные металлы из их соединений и образовывать новые химические связи.
Например, реакция натрия с водой выделяет большое количество тепла и образует гидроксид натрия:
2Na + 2H2O -> 2NaOH + H2
Однако, не все металлы обладают такой высокой активностью. Некоторые металлы, такие как золото и платина, являются менее активными и способны реагировать только с самыми сильными окислителями. Эта разница в активности металлов связана с их электрохимическим потенциалом и энергией связи.
Химические свойства металлов играют ключевую роль во многих отраслях науки и промышленности. Они используются в производстве различных материалов, включая металлические сплавы, проводники и катализаторы. Понимание химических свойств металлов позволяет улучшить эффективность и надежность металлических конструкций, разработать новые материалы и обнаружить новые химические реакции. В целом, изучение свойств металлов способствует прогрессу и развитию множества областей науки и технологии.
Металлы и их химические свойства

Металлы – это класс химических элементов с характерными физическими и химическими свойствами. Они обладают высокой электропроводностью, металлическим блеском, хорошей пластичностью и формируют катионы в химических реакциях.
Одним из основных химических свойств металлов является их высокая активность. Металлы могут реагировать с кислородом, образуя металлические оксиды. Например, железо реагирует с кислородом из воздуха и образует ржавчину – железооксид. Также металлы могут реагировать с водой, например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водород.
Химическая активность металлов зависит от их положения в периодической таблице элементов. Наиболее активные металлы находятся в левой части таблицы – щелочные и щелочноземельные металлы. Они легко реагируют с веществами, образуя соли и выделяя водород. В свою очередь, металлы в правой части таблицы, такие как золото и платина, имеют низкую активность и реагируют с веществами очень слабо.
Металлы широко используются в различных сферах промышленности и технологии. Их химические свойства, такие как высокая электропроводность и пластичность, делают их идеальными материалами для создания электрических проводов и металлических конструкций. Кроме того, металлы могут быть использованы в химических реакциях в качестве катализаторов, способствуя ускорению химических превращений.
Активность и реакции металлов
Металлы – это группа элементов, обладающих характерными химическими и физическими свойствами. Одним из важных свойств металлов является их активность, которая определяет их способность вступать в реакции с другими веществами.
Активность металлов зависит от их положения в ряду активности. Наиболее активными металлами являются щелочные и щелочноземельные металлы (например, натрий, калий, кальций), которые легко реагируют с кислородом, водой и кислотами. Они обладают высокой электроотрицательностью и, следовательно, легко отдают электроны в реакциях.
Реакции металлов могут быть различными. Например, многие металлы реагируют с кислородом при нагревании, образуя оксиды. Это явление известно как окисление металлов. Реакция металлов с водой также может протекать, в результате образуются оксиды или гидроксиды металлов и выделяется водород.
Некоторые металлы могут реагировать с кислотами, образуя соли и выделяя водород. Это свойство использовалось для определения активности металлов в химической лаборатории или на промышленных предприятиях. Чем выше активность металла, тем спонтаннее и более интенсивно проходит реакция.
Однако не все металлы реагируют одинаково. Некоторые металлы, такие как золото и платина, являются химически инертными и мало вступают в реакции с другими веществами.
Изучение активности и реакций металлов является важной частью химии и находит широкое применение в различных областях науки и техники.
Окисление металлов и их стабильность

Металлы способны образовывать оксиды в результате реакции с кислородом. Процесс окисления металлов может протекать как при обычных температурах, так и при повышенных, в зависимости от свойств металла. Окисление металлов является неизбежным явлением, так как они стремятся снизить свою энергию, переходя в более стабильные оксиды.
Стабильность металла в окислительных условиях зависит от его электрохимического потенциала. Металлы с более высокими значениями электрохимического потенциала, такие как алюминий, железо и цинк, имеют большую склонность к окислению и образованию стабильных оксидов. Такие оксиды могут быть использованы в качестве защитного слоя, предотвращающего дальнейшее окисление металла.
Существуют также некоторые металлы, которые проявляют особую стабильность в окислительных условиях. Например, платина и золото практически не подвержены окислению и сохраняют свой блеск и металлический вид даже при длительном воздействии кислорода. Это связано с их низкой электрохимической активностью и высокой стабильностью.
Возможность окисления металлов имеет важное значение в различных областях, включая производство материалов, электрохимические процессы, а также в биологии и медицине. Изучение химических свойств металлов и их стабильности при окислении позволяет эффективно использовать их в различных сферах и улучшать существующие технологии.
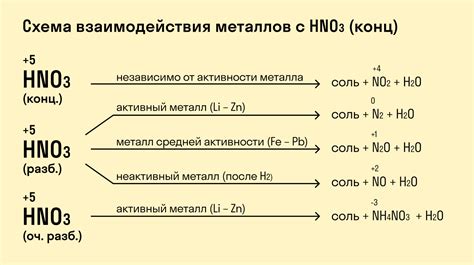
Кислотное взаимодействие металлов

Металлы - это элементы, которые обладают отличной проводимостью электрического тока и тепла. Однако, не все металлы взаимодействуют с кислотами одинаково. Как правило, активность металлов при кислотном взаимодействии зависит от их положения в ряду активности.
Неактивные металлы, такие как золото и платина, не взаимодействуют с кислотами при обычных условиях. Однако, более активные металлы, такие как цинк и алюминий, могут реагировать с растворами кислот, выделяяся водород. При этом металл растворяется, образуя соответствующие соли.
Реакция между металлом и кислотой может быть представлена следующим уравнением: металл + кислота → соль + водород. Например, когда цинк взаимодействует с соляной кислотой, образуется хлорид цинка и молекулярный водород:
Zn + 2HCl → ZnCl2 + H2
За счет своей активности, металлы могут использоваться в качестве восстановителей в различных химических процессах. Некоторые активные металлы, такие как натрий и калий, также могут реагировать с водой, выделяясь водород и образуя соответствующие щелочи.
Таким образом, кислотное взаимодействие металлов зависит от их активности и может использоваться в химических реакциях и промышленных процессах.
Взаимодействие металлов с щелочами

Щелочи - это химические соединения, имеющие щелочную реакцию и обладающие щелочными свойствами. Они позволяют добывать и использовать множество металлов.
Взаимодействие металлов с щелочами происходит в результате образования соединения - соли водорода, источником которой является кислород, присутствие которого необязательно.
Для неактивных металлов вода играет роль щелочи в этом взаимодействии. Их реакция протекает медленно, с выделением водорода и образованием гидроксида металла, например, Na + H2O = NaOH + H2.
С активными металлами взаимодействие с щелочами более интенсивное и является экзотермическим процессом с выделением большого количества водорода и образованием гидроксида металла. Например, K + H2O = KOH + H2.
Взаимодействие металлов с щелочами можно использовать для получения соответствующих гидроксидов, которые имеют широкое применение в различных отраслях промышленности, а также для получения водорода, используемого в качестве источника энергии.
Способность металлов к образованию соединений

Металлы обладают особой способностью к образованию соединений. Это связано с их электрохимической активностью. Металлы стремятся передать электроны и образовать положительно заряженные ионы, которые образуют ионосоединения с отрицательно заряженными ионами (анионами).
Способность металлов к образованию соединений зависит от их электронной структуры и расположения в периодической системе. Наиболее активными металлами являются алкалии и щелочноземельные металлы. Они легко отдают свои валентные электроны, образуя положительно заряженные ионы, которые с легкостью соединяются с отрицательно заряженными ионами.
Металлы могут образовывать различные виды соединений, включая металлические сплавы, ионосоединения, ковалентные соединения и координационные соединения. Металлические сплавы образуются при смешении двух или более металлов, где атомы металлов занимают узлы кристаллической решетки.
Ионосоединения металлов образуются при соединении металлов с неметаллами. Металлы отдают свои валентные электроны неметаллу, образуя положительно заряженные ионы металла и отрицательно заряженные ионы неметалла. В итоге образуется решетка ионосоединения.
Ковалентные соединения металлов образуются при соединении металлов с другими металлами или неметаллами. В этом случае металлы обычно образуют ковалентные связи с другими элементами, обладающими высокой электроотрицательностью. Ковалентные соединения металлов характеризуются наличием сильных химических связей и специфическими свойствами.
Координационные соединения металлов образуются при образовании комплексов металла с лигандами, которые образуют органические или неорганические вещества, содержащие атомы, способные образовывать связи с металлом через общие электроны.
Общие характеристики металлов
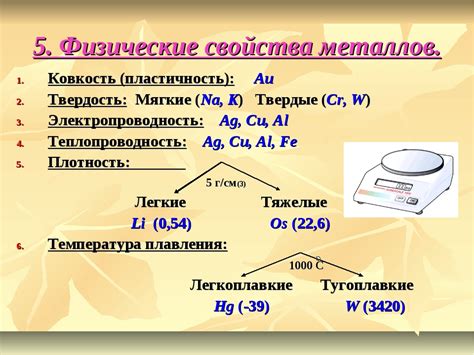
Металлы - это группа химических элементов, обладающих специфическими физическими и химическими свойствами. Они обладают высокой электропроводностью, теплопроводностью и пластичностью.
Одной из главных характеристик металлов является металлический блеск, который проявляется благодаря способности металлов отражать свет. Этот блеск объясняется свободным движением электронов в металлической решетке.
Еще одной важной характеристикой металлов является их высокая прочность. Молекулы металлов расположены в решетке, образующей кристаллическую структуру, что придает им высокую прочность и способность выдерживать большие нагрузки.
Металлы обладают высокими температурами плавления и кипения. Большинство металлов имеют температуры плавления выше 1000 градусов Цельсия, что позволяет им сохранять свою форму и механические свойства даже при высоких температурах.
Большинство металлов обладает химической реактивностью. Они способны взаимодействовать с различными веществами, проявляя кислотные или основные свойства. Некоторые металлы обладают амфотерными свойствами, то есть могут проявлять и кислотные, и основные свойства в зависимости от условий реакции.
В целом, металлы являются широко используемыми материалами благодаря своим уникальным свойствам. Они находят применение в различных отраслях промышленности, от машиностроения до электроники, и являются неотъемлемой частью нашей повседневной жизни.
Вопрос-ответ

Какие факторы влияют на активность металлов?
На активность металлов влияют несколько факторов. Один из главных факторов - реактивность металла, которая зависит от его электроотрицательности. Более электроотрицательные металлы обладают большей активностью. Также влияет наличие окисла, покрывающего поверхность металла. Если окисел легко образует растворимые соли, металл будет более активен. Другой важный фактор - концентрация основной среды, в которой находится металл. Чем больше концентрация водородиона, тем безопаснее металл.
Какие реакции металлов с водой являются химическими?
Некоторые металлы могут реагировать с водой, образуя гидроксиды и выделяя водород. Реакция натрия с водой является классическим примером. Металл натрия реагирует с водой, образуя гидроксид натрия и выделяя водородный газ. Реакция 2Na + 2H2O → 2NaOH + H2 обычно сопровождается выделением пламени, так как выделяющийся водород горит. Подобные реакции также могут проявляться и у других металлов, таких как калий, кальций и литий.
