Азотная кислота – одно из самых распространенных неорганических соединений, которое широко используется в различных отраслях промышленности. Взаимодействие азотной кислоты с металлами является одной из важных реакций в химии, которая имеет свои особенности и применение.
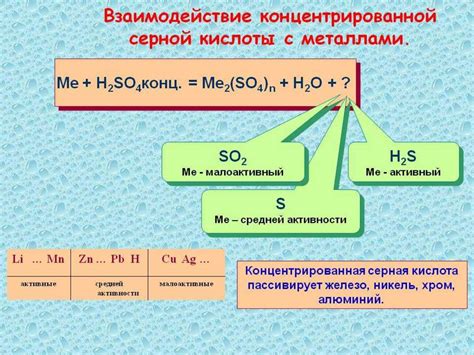
Одной из особенностей взаимодействия азотной кислоты с металлами является ее окислительная способность. Азотная кислота является сильным окислителем и способна окислять множество металлов, включая железо, медь, цинк и другие. В результате этой реакции образуется нитрат металла.
Взаимодействие азотной кислоты с металлами также сопровождается выделением газа – оксидов азота. Образование оксидов азота происходит вследствие взаимодействия азотной кислоты с кислородом воздуха. Этот процесс может протекать с выделением тепла и высокими температурами.
Реакция азотной кислоты с металлами может протекать как в кислой, так и в щелочной среде. В кислой среде окислительные свойства азотной кислоты усиливаются благодаря обратной реакции диссоциации кислоты.
Взаимодействие азотной кислоты с металлами может иметь практическое применение. Например, нитраты меди, свинца и других металлов используются в качестве реагентов в химической промышленности, а также в производстве удобрений. Кроме того, азотная кислота является важным компонентом при производстве взрывчатых веществ.
Таким образом, взаимодействие азотной кислоты с металлами – это важная химическая реакция, характеризующаяся окислительными свойствами кислоты. Это взаимодействие имеет свои особенности, которые определяются средой, в которой оно происходит, и может иметь практическое применение в промышленности.
Азотная кислота и ее свойства

Азотная кислота (HNO3) является одной из наиболее сильных минеральных кислот. Она обладает рядом уникальных свойств и проявляет активность при взаимодействии с различными веществами, включая металлы.
Свойства азотной кислоты обусловлены ее структурой и химическим составом. Она представляет собой бесцветную жидкость с характерным едким запахом. Она хорошо растворяется в воде и образует с ней гидратированный ион H3O+. Кроме того, азотная кислота является окислителем, способным образовывать нитрозные окислительные группы (-NO2) и осуществлять окислительные реакции.
Одним из важных свойств азотной кислоты является ее сильная кислотность. При диссоциации она образует ионы H+ и NO3-, которые являются активными веществами для реакций с металлами. Азотная кислота может реагировать с различными металлами, образуя нитраты и выделяя газы, такие как оксиды азота или азотистый газ.
Взаимодействие азотной кислоты с металлами происходит в зависимости от их активности. Некоторые металлы, такие как натрий или калий, реагируют с кислотой очень активно, при этом выделяется большое количество тепла и образуются нитраты. Другие металлы, такие как железо или медь, могут образовывать оксиды, нитриты или азиды.
В целом, взаимодействие азотной кислоты с металлами является сложным и зависит от множества факторов, включая активность металла, концентрацию кислоты и условия реакции. Это делает азотную кислоту важным соединением для различных химических и технических процессов, включая производство удобрений, пиротехники и других взрывчатых смесей.
Структура и химическая формула

Азотная кислота (HNO3) представляет собой бесцветную жидкость с характерным едким запахом. В ее молекуле находятся три атома кислорода, один атом азота и один атом водорода. Химическая формула HNO3 указывает на то, что в каждой молекуле азотной кислоты находится одна группа кислород-водород.
Структура азотной кислоты включает одну кислородную группу (OH) и одну нитрогруппу (NO2). В молекуле азотной кислоты атомы связаны через сильные ковалентные связи, что придает ей молекулярную поларность. Именно эта поларность позволяет азотной кислоте обладать такими свойствами, как высокая электрофильность и сильная кислотность.
Химические формулы позволяют точно описывать состав и структуру вещества. В случае с азотной кислотой, формула HNO3 указывает на наличие одноатомного водорода, одноатомного азота и трехатомного кислорода в ее молекуле. Знание химической формулы позволяет ученым лучше понять особенности взаимодействия данного вещества с металлическими элементами и прогнозировать реакции, происходящие между ними.
Физические и химические свойства
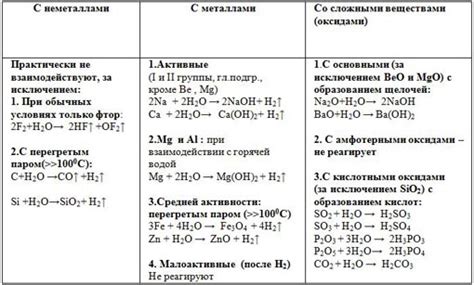
Азотная кислота, также известная как азотная вода, является бесцветной жидкостью с характерным резким запахом. Она обладает высокой плотностью и вязкостью. Точка кипения азотной кислоты составляет около 83°C, а точка замерзания – около -42°C.
Химические свойства азотной кислоты определяются ее сильными окислительными свойствами. Взаимодействуя с различными металлами, она проявляет разнообразные реакции. Например, азотная кислота способна разложить алюминий, образуя азотистый оксид и воду:
8HNO3 + 2Al → 2Al(NO2)3 + 6H2O
Кроме того, азотная кислота может проявлять амфотерное поведение, образуя соли с металлами различных степеней окисления. Так, с низкими окислительными состояниями металлов (например, с ионами Fe2+) образуются азотнокислые соли, а с высокими окислительными состояниями (например, с ионами Fe3+) – азотнокислая соль.
Важно отметить, что азотная кислота является коррозионно-активной веществом и способна разрушать металлические поверхности. При взаимодействии с металлами она обычно образует соответствующие нитраты.
Применение азотной кислоты
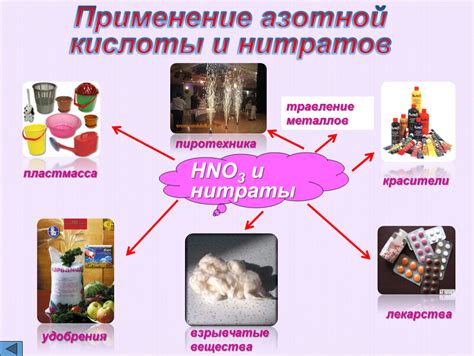
Азотная кислота, или азотная выжигающая кислота, NH3, широко применяется в различных отраслях промышленности и научных исследованиях. Благодаря своим химическим свойствам, она нашла применение в производстве взрывчатых веществ, удобрений, красителей, ракетного топлива и других продуктов.
Азотная кислота является одним из основных компонентов, используемых для синтеза различных взрывчатых веществ, таких как тринитротолуол (ТНТ) и другие нитроэстры. Ее способность окислять и разлагать органические соединения позволяет создавать высокоэффективные взрывчатые смеси.
Кроме того, азотная кислота является неотъемлемым компонентом в производстве удобрений. В аграрной отрасли она используется для синтеза нитроудобрений, содержащих азот, который является основным питательным элементом для растений. Азотные удобрения позволяют повысить урожайность и качество сельскохозяйственных культур.
Также азотная кислота применяется в процессе изготовления красителей, используемых в текстильной промышленности. Она служит реагентом в реакции окисления анилина, получаемого из бензола, и позволяет получить разнообразные красящие вещества.
Азотная кислота играет важную роль и в космической отрасли, где она используется в производстве ракетного топлива. Благодаря способности азотной кислоты к горению и ее высокой энергетической плотности, она является важным компонентом для создания высокоэффективных ракетных двигателей.
Взаимодействие азотной кислоты с металлами

Азотная кислота, или азотистая кислота (HNO3), является важным химическим соединением, которое широко используется в промышленности и лабораторных исследованиях. Она обладает сильной окислительной способностью и может реагировать с многими металлами.
При взаимодействии азотной кислоты с металлами образуются соответствующие нитраты. Реакция происходит следующим образом: азотная кислота (HNO3) отдаёт протон, образуя нитратный ион (NO3-), который вступает в реакцию с металлом, образуя нитрат металла.
Реактивность металлов в отношении азотной кислоты зависит от их электрохимического потенциала и степени пассивации. Некоторые металлы, такие как активные металлы низкой степени пассивации (например, магний или алюминий), реагируют с азотной кислотой быстро и сильно, выделяя большое количество газообразных продуктов.
Однако некоторые металлы, такие как платина или золото, не проявляют реактивность и не реагируют с азотной кислотой. Это связано с их высокой устойчивостью и пассивацией под влиянием оксидной пленки на их поверхности.
Взаимодействие азотной кислоты с металлами и их сплавами может быть использовано в процессе очистки и обработки металлов, а также в процессе получения различных химических соединений и препаратов.
Основные типы реакций

Взаимодействие азотной кислоты с металлами может происходить по разным механизмам, в результате которых образуются различные соединения. Одним из основных типов реакций является образование нитратов металлов. Нитраты представляют собой соли азотной кислоты, в которых катионом выступает металл.
При взаимодействии азотной кислоты с активными металлами, такими как натрий или калий, происходит их окисление до катиона металла и выделение молекулярного азотного газа. Эта реакция является одной из основных в химии азотной кислоты.
Также азотная кислота может образовывать аммиант, который представляет собой сложное соединение между металлом и атмосферным азотом. Аммиант обладает высокой степенью стабильности и может использоваться в промышленности как удобрение.
Еще одним типом реакции является образование азотидов, которые представляют собой соли в которых анионом выступает атом азота. Азотиды металлов часто применяются в пиротехнике, так как они обладают хорошей невоспламеняемостью и яркими цветами при горении.
Кинетика реакции

Кинетика реакции между азотной кислотой и металлами определяет скорость и механизм процесса. Скорость реакции зависит от концентрации и температуры реагентов, поверхности металла и наличия катализаторов.
Взаимодействие между азотной кислотой и металлами рассматривается как сложная неоднородная реакция, включающая несколько стадий. Первой стадией является адсорбция азотной кислоты на поверхности металла, что приводит к образованию промежуточных соединений.
Кинетические параметры этой реакции (энергия активации, скорость реакции и т. д.) зависят от металла, его поверхности и концентрации азотной кислоты. Например, увеличение концентрации азотной кислоты приводит к увеличению скорости реакции, так как это увеличивает количество молекул реагента, способных адсорбироваться на поверхности металла.
Кинетика реакции азотной кислоты с металлами также зависит от температуры. Повышение температуры увеличивает активность металла и способствует происходящим реакциям. Однако, при очень высоких температурах возможно разложение азотной кислоты и образование других продуктов.
Кинетика реакции между азотной кислотой и металлами может быть изучена экспериментально и теоретически. Экспериментальные данные позволяют определить скорость реакции при различных условиях. Теоретическая модель реакции помогает объяснить наблюдаемые результаты и предсказать поведение системы при изменении условий.
Примеры реакций с различными металлами

Азотная кислота взаимодействует с металлами, образуя соответствующие нитраты. Например, сильнокислая азотная кислота образует нитраты с ионами меди, цинка и серебра. При этом происходит выделение диоксида азота и образование растворов, которые могут иметь окраску от светло-голубого до темно-синего цвета.
Металлы, такие как железо, никель и алюминий, могут реагировать с азотной кислотой при нагревании. В результате таких реакций образуются оксиды металлов и соляные кислоты, например, оксиды железа и никеля реагируют с азотной кислотой, образуя соответствующие нитраты и соляную кислоту. Эти реакции сопровождаются выделением газов, таких как диоксид азота и оксиды металлов.
Взаимодействие азотной кислоты с щелочными и щелочноземельными металлами, такими как натрий, калий и кальций, приводит к образованию нитратов и соответствующих гидроксидов. Эти реакции являются экзотермическими и сопровождаются выделением тепла. Например, реакция азотной кислоты с натрием приводит к образованию нитрата натрия и гидроксида натрия.
Некоторые металлы, такие как алюминий и цинк, образуют защитные слои оксидов на своей поверхности, которые препятствуют дальнейшему взаимодействию с азотной кислотой. Однако, при достаточно высокой концентрации азотной кислоты и длительном воздействии, эти металлы также могут реагировать с образованием соответствующих нитратов.
Таким образом, взаимодействие азотной кислоты с различными металлами может приводить к образованию нитратов и соляных кислот, а также выделению газов и тепла. Эти реакции зависят от концентрации азотной кислоты, типа металла и условий взаимодействия.
Влияние условий на характер реакции

Характер реакции взаимодействия азотной кислоты с металлами может зависеть от условий проведения эксперимента. Один и тот же металл может вести себя по-разному при различных температурах, концентрациях азотной кислоты и прочих условиях.
При повышенной температуре и высокой концентрации азотной кислоты реакция сильно ускоряется и может проходить взрывоопасно, особенно с активными металлами, такими как магний или натрий. В этом случае образуется высокоэнергетическое соединение, что приводит к быстрому и интенсивному протеканию реакции.
Однако при низкой концентрации азотной кислоты и комнатной температуре реакция может протекать медленно или вообще не происходить. В таких условиях образование оксида металла может быть несущественным или отсутствовать полностью.
Степень окисления металла в ходе взаимодействия с азотной кислотой также зависит от условий проведения эксперимента. Высокая концентрация кислоты и низкая температура может способствовать образованию высокостепенных окислов металла. Наоборот, низкая концентрация и высокая температура скорее приведут к образованию низкостепенных окислов металла.
Таким образом, условия проведения эксперимента имеют важное значение для характера реакции между азотной кислотой и металлами. Они определяют скорость и степень окисления металла, а также могут влиять на безопасность проведения реакции.
Вопрос-ответ

Что такое азотная кислота?
Азотная кислота (HNO3) является одной из самых важных и широко используемых кислот в химии. Она представляет собой бесцветную или желтоватую жидкость с характерным запахом. Азотная кислота имеет множество промышленных и лабораторных применений, а также является важным реагентом в органической и неорганической химии.
Каковы особенности взаимодействия азотной кислоты с металлами?
Азотная кислота обладает высокими окислительными свойствами и может взаимодействовать с многими металлами. При этом происходят различные реакции, в зависимости от условий и конкретного металла. Взаимодействие может приводить к образованию нитратов металлов, выделению оксидов, аммиака, оксидов азота и других продуктов.
Какие реакции могут возникать при взаимодействии азотной кислоты с металлами?
При взаимодействии азотной кислоты с металлами могут возникать различные реакции. Например, с некоторыми активными металлами, такими как медь или железо, происходит окисление металла с образованием нитратов. С другими металлами, такими как алюминий или цинк, может происходить реакция выделения газа (аммиака или оксидов азота). Также возможно образование осажденных оксидов металлов.
Какие металлы реагируют с азотной кислотой?
Азотная кислота может взаимодействовать с большим количеством металлов. Однако, наиболее активно она реагирует с металлами, имеющими положительный электродный потенциал. Например, такими металлами являются железо, медь, цинк, никель и алюминий. Металлы с более низкими электродными потенциалами, такие как золото или серебро, реагируют с азотной кислотой значительно медленнее или могут вообще не реагировать.