Атомы металлов являются основными строительными единицами всех металлических веществ. Они обладают рядом уникальных особенностей, которые определяют их свойства и поведение вещества в целом. В отличие от других элементов, атомы металлов обладают особыми электронными уровнями и подобным свойством, как деформация кристаллической решетки. Эти особенности обусловливают высокую теплопроводность, электропроводность и пластичность металлов.
Одной из уникальных особенностей атомов металлов является их способность образовывать металлическую связь, которая характеризуется наличием свободных электронов в зоне проводимости. Это позволяет атомам металлов образовывать кристаллические решетки, которые обеспечивают металлам их характерные механические и физические свойства.
Например, в кристаллической решетке железа атомы железа образуют круговые плоскости, в которых связаны друг с другом ионными связями. При деформации эти плоскости смещаются относительно друг друга, что позволяет железу обладать пластичностью и деформироваться без разрушения.
Кроме того, атомы металлов обладают большим количеством свободных электронов, которые отвечают за высокую электропроводность металлов. Эти электроны могут свободно двигаться внутри металлической решетки, что обеспечивает передачу электрического тока без сопротивления. Этот феномен называется "металлической электропроводностью" и является одним из ключевых свойств металлов.
Таким образом, атомы металлов обладают уникальными особенностями, которые определяют свойства и поведение металлов. Эти особенности позволяют металлам быть пластичными, хорошими проводниками тепла и электричества, а также обладать рядом других полезных свойств, делающих их востребованными материалами в различных отраслях промышленности.
Строение атомов металлов
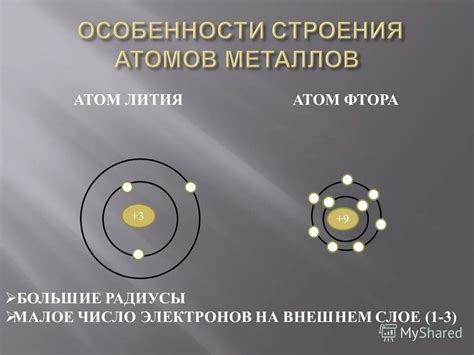
Атомы металлов отличаются своей особой структурой, которая обеспечивает им уникальные физические и химические свойства.
Основной элемент металлов - ядро, состоящее из протонов и нейтронов, окруженное электронными облаками. Электроны, в свою очередь, находятся на различных энергетических уровнях, или оболочках.
У атомов металлов обычно есть несколько энергетических уровней. На самом внешнем уровне находятся электроны, называемые валентными электронами. Они играют важную роль в химических реакциях и взаимодействии атомов металлов с другими элементами.
Особенность атомов металлов заключается в том, что валентная оболочка неполностью заполнена, что делает металлы электропроводными. Это связано с тем, что на внешней оболочке металлов находится мало электронов, чем больше атом, тем меньше у электрона свободных соседей, что условно можно считать сильно негативным зарядом на внешнем слое атома металла.
Также металлы обладают тем, что у них нет почти полностью заполненных энергетических полос. Благодаря этому, электроны металлов могут легко передвигаться по атомам и обеспечивать электропроводность металлов.
Уникальные особенности атомов металлов

1. Большое количество валентных электронов. Атомы металлов отличаются от других элементов тем, что у них значительное количество валентных электронов, то есть электронов, участвующих в химических связях. Такая особенность обеспечивает металлам высокую реакционную способность и возможность образования стабильных соединений.
2. Гомогенность структуры. В отличие от неметаллов, у атомов металлов обычно одинаковое количество электронов во всех своих энергетических уровнях. Это делает их структуру гомогенной и позволяет металлам образовывать кристаллическую решетку с регулярной повторяемостью.
3. Способность к образованию ионов положительной зарядности. Атомы металлов имеют большое число валентных электронов, которые могут легко быть отданы. Поэтому металлы имеют свойство образовывать ионы с положительной зарядностью, так как они отдают свои валентные электроны.
4. Способность к образованию межатомных связей. Металлы имеют способность образовывать межатомные связи, что позволяет им образовывать сложные структуры, такие как сплавы. Это делает металлы уникальными материалами с разнообразными свойствами и широким применением в индустрии и технологии.
5. Высокие температуры плавления и кипения. Большинство металлов обладает высокими температурами плавления и кипения, что связано с их особенностями строения атомов и наличием сильных межатомных связей. Это делает металлы особенно полезными во многих отраслях промышленности, включая металлургию, строительство и электронику.
Примеры металлов с особым строением атомов

Металлы обладают особым строением атомов, которые образуют кристаллическую решетку и обладают специфическими свойствами. Некоторые металлы характеризуются особенностями в строении атомов, которые делают их уникальными в своем роде.
Один из примеров металлов с особым строением атомов - железо. Атомы железа образуют кубическую решетку, которая обеспечивает высокую прочность и твердость этого металла. Железо является одним из основных конструкционных материалов и широко используется в строительстве и машиностроении.
Еще один пример металла с особым строением атомов - алюминий. Атомы алюминия образуют ромбическую решетку, которая обладает высокой электропроводностью и хорошей коррозионной стойкостью. Алюминий широко применяется в аэрокосмической промышленности, автомобилестроении и упаковочной промышленности.
Еще один пример - магний. Атомы магния образуют гексагональную решетку, которая обеспечивает легкость и прочность этого металла. Магний применяется в авиационной и автомобильной промышленности, а также в производстве спортивных товаров.
Вопрос-ответ

Каковы уникальные особенности строения атомов металлов?
Уникальные особенности строения атомов металлов включают наличие свободных электронов в валентной оболочке, что обусловливает их высокую проводимость электричества и тепла, а также их металлический блеск и пластичность.
Какие примеры можно привести в качестве иллюстрации уникальных особенностей строения атомов металлов?
Примерами металлов с уникальными особенностями строения атомов в являются золото и серебро. Атомы золота имеют 79 электронов, из которых 2 находятся в первом энергетическом уровне, 8 - во втором и 18 - в третьем. В валентной оболочке находится 1 электрон, который легко отдается и обусловливает высокую реакционную способность золота. Атомы серебра имеют 47 электронов, из которых 2 находятся в первом энергетическом уровне, 8 - во втором и 18 - в третьем. В валентной оболочке находится 1 электрон, который также легко отдается и обусловливает высокую реакционную способность серебра.
