Металлы побочных подгрупп являются одной из самых широко распространенных и важных групп элементов в периодической системе химических элементов. Они составляют основную часть многих природных и искусственных материалов, используемых в различных отраслях промышленности и науке. Для понимания свойств металлов побочных подгрупп необходимо изучать их строение на атомарном уровне.
Особенности строения атомов металлов побочных подгрупп связаны, прежде всего, с их электронной структурой. Атомы металлов побочных подгрупп характеризуются наличием одной или нескольких валентных электронов, которые могут участвовать в химических реакциях с другими атомами. Такая электронная конфигурация обуславливает высокую химическую активность металлов побочных подгрупп и их способность образовывать сильные связи с другими элементами.
Кроме того, атомы металлов побочных подгрупп обладают большими размерами и массой, что делает их атомы тяжелыми и плотными. Это связано с наличием большого количества электронов внешней электронной оболочке, которые занимают большую площадь и образуют сильные взаимодействия с другими атомами. Такое строение атомов металлов побочных подгрупп придает им характерные физические и химические свойства, такие как высокая теплопроводность, электропроводность и пластичность.
Структура атомов металлов побочных подгрупп: особенности и свойства
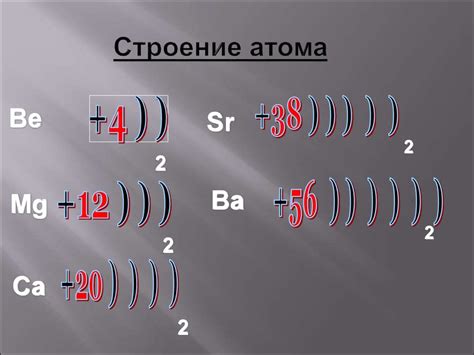
Металлы побочных подгрупп включают такие элементы, как медь, серебро и золото. Они обладают высокой электропроводностью и хорошей пластичностью, что делает их ценными для промышленности и ювелирных изделий.
Структура атомов металлов побочных подгрупп отличается от структуры атомов других элементов. Они имеют одну или две валентные электронные оболочки, что позволяет им образовывать стабильные и прочные межатомные связи.
Элементы металлов побочных подгрупп обладают высокой плотностью и тугоплавкостью. Они образуют кристаллическую решетку, в которой каждый атом окружен другими атомами, что обеспечивает их механическую прочность.
Одной из особенностей структуры атомов металлов побочных подгрупп является их способность образовывать сплавы и легирование. Путем добавления других элементов к основному металлу можно изменить его свойства, такие как твёрдость, прочность и коррозионную стойкость.
Выводя их на поверхность, металлы побочных подгрупп часто приобретают блеск и металлический оттенок, что делает их популярными для использования в ювелирных изделиях и декоративных элементах.
Электронное строение атомов металлов побочных подгрупп
Металлы побочных подгрупп – это элементы периодической системы, которые находятся в двух группах: VIII и IX. Представители VIII группы называются железом, а представители IX группы – медью, серебром и золотом. У атомов металлов побочных подгрупп есть особенности в электронном строении.
Атомы металлов побочных подгрупп имеют свободные внешние электроны в своих электронных оболочках. В случае VIII группы у атома Железа, на внешней энергетической уровне находятся два электрона, что делает его химически активным. В то же время, атома серебра, золота и меди в IX группе имеют один электрон на внешней энергетической оболочке. Это делает эти элементы еще более химически активными и способными образовывать разнообразные соединения.
Как металлы побочных подгрупп имеют малое число внешних электронов, они являются хорошими проводниками электричества и тепла. В случае VIII группы, атомы железа образуют кубическую решетку, где каждый атом связан с восьмью ближайшими атомами. Атомы металлов побочных подгрупп IX группы, такие как золото и медь, образуют также кубическую решетку, но с одним лишь атомом в центре куба.
Электронное строение атомов металлов побочных подгрупп позволяет им образовывать различные соединения, обладать металлическими свойствами и использоваться во многих областях, включая промышленность и науку.
Орбитали и заполнение электронных оболочек металлов побочных подгрупп
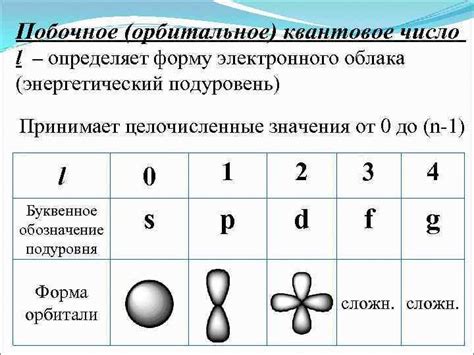
Атомы металлов побочных подгрупп имеют сложное строение, которое определяется расположением и заполнением их электронных оболочек. Электронные оболочки состоят из энергетических уровней, называемых орбиталями. Каждая орбиталь может вместить определенное количество электронов, и заполнение электронных оболочек металлов побочных подгрупп происходит в соответствии с принципом возрастания энергии орбиталей и правилами Хунда.
Металлы побочных подгрупп находятся в d- и f-блоках периодической системы элементов. Орбитали d-подуровней имеют форму двояковыпуклого диска с различной ориентацией в пространстве. Оболочка d-орбиталей выполняет важную роль в строении атома металла. В одну d-оболочку могут вместиться до 10 электронов.
Заполнение электронных оболочек металлов побочных подгрупп происходит по принципу наименьшей энергии, согласно правилам Хунда. Согласно правилу Хунда, электроны заполняют орбитали таким образом, чтобы обеспечить минимальную энергию системы. При заполнении электронов в орбитали одного подуровня, сначала заполняются орбитали с одиночным электроном, затем орбитали с двумя электронами в противоположных спинах.
Заполнение электронных оболочек металлов побочных подгрупп подчиняется также правилу максимальной мультипликации. Это означает, что электроны с одним и тем же спином заполняют орбитали, прежде чем заполняются орбитали с противоположным спином. Заполнение электронных оболочек металлов побочных подгрупп происходит до заполнения d-подуровней, и только после этого начинается заполнение последующих энергетических уровней.
Ядро атома металла побочной подгруппы
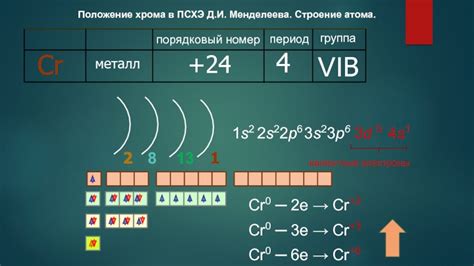
Ядро атома металла побочной подгруппы представляет собой центральную часть атома, содержащую протоны и нейтроны. Протоны являются элементарными частицами, обладающими положительным зарядом, в то время как нейтроны не имеют заряда.
Ядро атома металла побочной подгруппы обладает высокой плотностью и массой. Количество протонов в ядре определяет атомный номер элемента и его положение в периодической системе. Количество нейтронов может варьироваться у атомов одного и того же элемента, образуя изотопы.
Ядро атома металла побочной подгруппы обладает большой энергией, которая может высвобождаться при ядерных реакциях. Это свойство делает металлы побочной подгруппы важными источниками энергии, например, в рамках использования ядерной энергетики.
Ядро атома металла побочной подгруппы также является источником сильного магнитного поля. Это свойство позволяет использовать металлы побочной подгруппы в создании магнитов и различных устройств, включая электродвигатели и генераторы.
Ядро атома металла побочной подгруппы обладает стабильностью, но в некоторых случаях может распадаться, испуская радиоактивное излучение. Это свойство делает некоторые изотопы металлов побочной подгруппы полезными в медицине для радиотерапии и диагностики различных заболеваний. Также изотопы могут использоваться в анализе с помощью радиоизотопной маркировки.
Атомные радиусы и валентность металлов побочных подгрупп
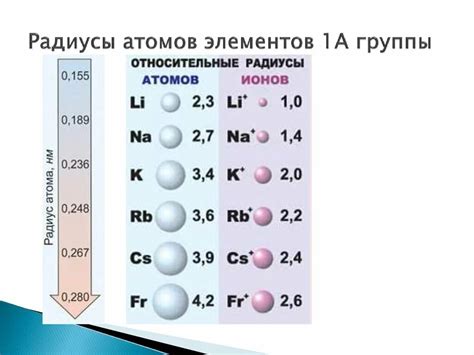
Металлы побочных подгрупп – это элементы периодической системы, которые находятся справа от периода переходных металлов и группами в состоянии d-элементов. Одной из важных характеристик атомов металлов побочных подгрупп является их атомный радиус.
Атомный радиус металлов побочных подгрупп определяет размер атома и его межатомные расстояния в кристаллической решетке. Обычно атомный радиус увеличивается по мере перехода вниз по группе, но есть и исключения. Например, у элементов 3D-периода атомные радиусы меняются нерегулярно, что связано с эффектами экранировки ядра электронами внутренних оболочек и с пролетариатомами.
Важную роль в свойствах металлов побочных подгрупп играет их валентность. Валентность – это число внешних электронов, участвующих в химических связях при образовании соединений. У металлов побочных подгрупп валентность может быть различной в различных соединениях.
Например, валентность магния (Mg) в соединении оксида магния (MgO) равна +2, так как атом магния отдает два электрона, образуя положительный ион. В то же время, в соединении хлорида магния (MgCl2) валентность магния равна +2, так как атом магния отдает два электрона двум атомам хлора, образуя положительный ион Mg2+.
Таким образом, атомные радиусы и валентность металлов побочных подгрупп взаимосвязаны и определяют химические свойства этих элементов.
Химические свойства металлов побочных подгрупп на основе строения атомов
Металлы побочных подгрупп обладают особыми химическими свойствами, связанными с устройством и строением их атомов. В основе этих свойств лежат электронные оболочки атомов металлов, которые имеют определенную структуру.
Атомы металлов побочных подгрупп обычно имеют большое количество внешних электронов, что делает их химически активными. Из-за этого они легко образуют ионы, уступая электроны. В результате образуется положительный заряд металла и в отрицательной заряженной среде образуется электронное облако, способное передвигаться. Именно этим обусловлена способность металлов проводить электрический ток.
Свойство металлов побочных подгрупп образовывать положительные ионы также влияет на их реакционную способность. Они легко реагируют с отрицательно заряженными анионами, образуя соли. Также металлы могут проводить реакцию с водородом, образуя соединения - гидриды.
Строение атомов металлов побочных подгрупп также объясняет их способность образовывать различные соединения. Атомы металлов могут образовывать связи как с другими атомами металлов, так и с атомами неметаллов. Эти связи создают разнообразные химические соединения, например, бинарные и тернарные соединения.
Благодаря строению своих атомов, металлы побочных подгрупп обладают высокой тепло- и электропроводностью, а также механической прочностью. Именно поэтому они широко используются в различных отраслях промышленности, электротехнике и строительстве.
Физические свойства металлов побочных подгрупп, определяемые структурой атомов

Структура атомов металлов побочных подгрупп имеет ряд особенностей, которые существенно влияют на физические свойства данных материалов.
Первое отличие заключается в наличии свободных электронов в валентной оболочке атомов металлов побочных подгрупп. Это позволяет им образовывать металлические связи между атомами. Такие связи обладают хорошей проводимостью электрического тока, поэтому металлы побочных подгрупп являются отличными проводниками.
Кроме того, структура атомов металлов побочных подгрупп обеспечивает им высокую пластичность и формоизменяемость. Это объясняется наличием "моря" свободных электронов, которые могут перемещаться в кристаллической решетке металла. В результате, металлы побочных подгрупп способны легко поддаваться деформации без разрушения и приобретать желаемую форму.
Кроме того, структура атома определяет плотность металла побочной подгруппы. В результате, металлы побочных подгрупп обладают высокой плотностью, что делает их тяжелыми и компактными материалами. Это позволяет использовать их в различных областях, включая строительство, авиацию и промышленность.
Таким образом, структура атомов металлов побочных подгрупп определяет их уникальные физические свойства, такие как высокая проводимость электричества, пластичность и высокая плотность. Эти свойства делают металлы побочных подгрупп незаменимыми материалами во многих сферах жизни.
Роль строения атомов металлов побочных подгрупп в их химической и физической активности

Строение атомов металлов побочных подгрупп играет важную роль в их химической и физической активности. Металлы побочных подгрупп обладают особенными характеристиками, определяемыми электронной конфигурацией и особенностями внешней оболочки атомов.
Атомы металлов побочных подгрупп имеют относительно небольшое количество электронов в внешней оболочке. Это позволяет им легко отдавать электроны и образовывать ионы положительного заряда. Получение положительного заряда отдачей электронов определяет их реакционную способность и активность в химических реакциях.
Строение атомов металлов побочных подгрупп также обуславливает их физическую активность. Благодаря наличию свободных электронов в их внешней оболочке, металлы побочных подгрупп обладают хорошей электрической и теплопроводностью. Кроме того, они способны формировать металлические связи, образуя кристаллическую решетку, что придает им механическую прочность и пластичность.
Строение атомов металлов побочных подгрупп также влияет на их кислотно-основные свойства. Из-за низкой электроотрицательности и наличия свободных электронов, они обладают основными свойствами. Это позволяет им образовывать гидроксиды и соли с кислотами, проявляя себя как основания.
Таким образом, строение атомов металлов побочных подгрупп играет ключевую роль в определении их химической и физической активности. Они отличаются от других элементов своей особой реакционной способностью, способностью передавать электроны и формировать металлическую структуру. Эти свойства позволяют им широко использоваться в различных отраслях промышленности и технологии.
Вопрос-ответ

Какие особенности строения атомов металлов побочных подгрупп?
Особенности строения атомов металлов побочных подгрупп включают наличие неполного s- или d-электронного оболочки. Вследствие этого, эти металлы обладают особым набором физических и химических свойств.
Что такое неполная s- или d-электронная оболочка у атомов металлов побочных подгрупп?
Неполная s- или d-электронная оболочка означает, что эти атомы имеют не полностью заполненные электронные оболочки на уровнях s или d. Наличие неполных электронных оболочек в атомах вызывает специфичные электронные уровни, на которых происходят побочные химические и физические реакции.
Какие свойства обладают металлы побочных подгрупп?
Металлы побочных подгрупп обладают рядом свойств, таких как высокая электропроводность, теплопроводность и пластичность. Они также имеют способность образовывать сплавы и различные соединения, что делает их важными для промышленности и множества других отраслей.
В чем заключаются химические особенности металлов побочных подгрупп?
Химические особенности металлов побочных подгрупп связаны с их электронной структурой. Наличие неполной s- или d-электронной оболочки обуславливает возможность образования сложных соединений и реакций с другими веществами. Это позволяет металлам побочных подгрупп играть важную роль в химической промышленности.
Какое значение имеет структура атомов металлов побочных подгрупп в их физическом поведении?
Структура атомов металлов побочных подгрупп имеет решающее значение для их физического поведения. Например, электронная структура определяет электропроводность, теплопроводность и пластичность этих металлов. Именно эти свойства делают металлы побочных подгрупп важными материалами для различных отраслей промышленности и научных исследований.
