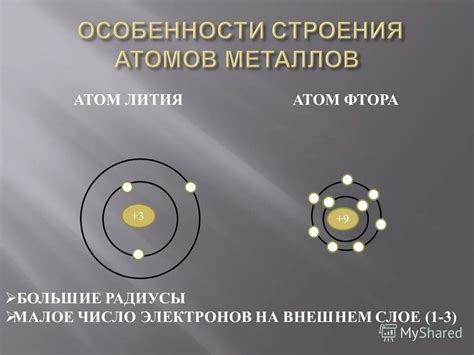
Строение атомов металлов имеет свои особенности, которые определяют их химические и физические свойства. Атомы металлов обладают большим количеством электронов в своей валентной оболочке, и, как следствие, меньшим энергетическим уровнем последнего внешнего электрона.
В атоме металла электроны распределены по энергетическим уровням, состоящим из орбиталей. Однако, особенностью строения атома металла является наличие малого количества электронов в последней валентной оболочке. Валентная оболочка - это наиболее далекая от ядра оболочка, которая содержит электроны, ответственные за химические связи.
Малое количество электронов на внешнем энергетическом уровне делает атом металла нестабильным. Это обусловлено тем, что относительно небольшая сила атомного ядра притягивает электроны, что делает внешний уровень более доступным для взаимодействия с другими атомами и молекулами.
Меньший внешний электронный уровень атомов металлов является причиной их высокой реакционности. Атомы металлов стремятся установить стабильное электронное состояние путем передачи своих внешних электронов другим атомам. Это обеспечивает образование ионов металлов с положительным зарядом, так как атом отдает свой электрон и становится ионом.
Строение атомов металлов
Атомы металлов имеют особенности, которые отличают их от атомов других элементов. В основе строения атомов металлов лежит их электронная оболочка. Атом состоит из ядра, в котором находятся протоны и нейтроны, а также электронной оболочки, где расположены электроны.
У атомов металлов электронная оболочка состоит из нескольких уровней энергии, но их наиболее внешний уровень, называемый валентным уровнем, является наиболее важным. На валентном уровне находятся электроны, которые определяют химические свойства металлов.
Валентные электроны металлов обладают высокой подвижностью, что является одной из основных причин, почему металлы обладают хорошей электропроводностью и теплопроводностью. Они легко перемещаются между атомами и создают электронное облако, которое обеспечивает проводимость электричества и тепла.
Основные особенности

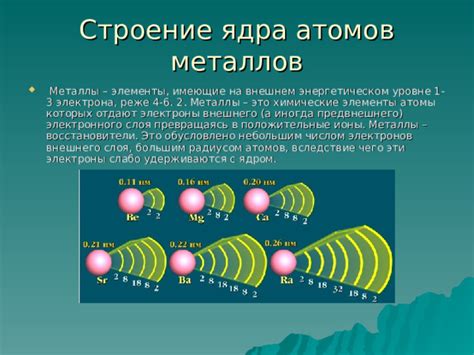
Атомы металлов имеют своеобразную структуру и отличаются от атомов других элементов. Одной из основных особенностей является наличие у металлов меньшего внешнего электронного уровня по сравнению с другими элементами. Это означает, что у атомов металлов на внешнем электронном уровне находится меньше электронов.
Такое строение атомов металлов связано с их местом в периодической таблице. Металлы находятся в левой и центральной частях таблицы и имеют меньший электронный номер, что определяет их особые характеристики. Меньшее количество электронов на внешнем электронном уровне делает атомы металлов более склонными к химической реактивности и образованию положительно заряженных ионов.
Электроны на внешнем электронном уровне также играют важную роль в определении химических свойств металлов. Они обеспечивают возможность образования связей с другими атомами, образуя кристаллическую решетку, которая придает металлам их уникальные физические свойства, такие как хорошая проводимость электричества и тепла, пластичность и блеск.
Таким образом, особенности строения атомов металлов и их меньший внешний электронный уровень определяют уникальные химические и физические свойства этих элементов, что делает их особо полезными во многих сферах жизни, от электроники до строительства.
Ядро и электроны
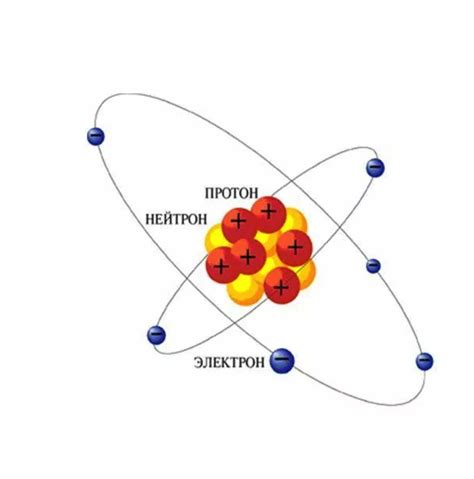
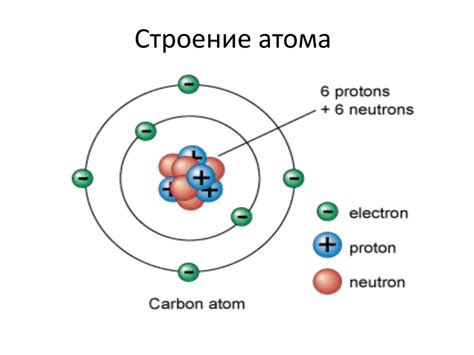
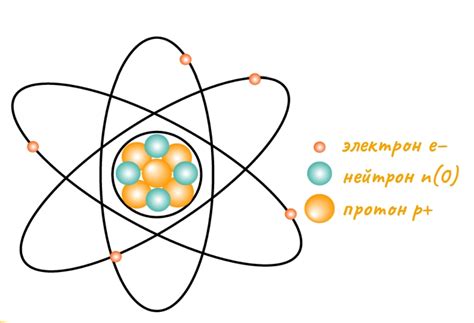
Атомы металлов состоят из ядра и электронов, которые образуют оболочки вокруг ядра. Ядро состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда. Протоны и нейтроны находятся вместе в небольшом пространстве ядра.
Электроны находятся за пределами ядра и образуют облако электронов вокруг него. Они имеют отрицательный электрический заряд, который компенсирует положительный заряд протонов в ядре. Количество электронов в атоме равно числу протонов в ядре. Каждый электрон находится в своей энергетической оболочке с определенным уровнем энергии.
Наиболее внешний уровень энергии, на котором находятся электроны, называется внешним электронным уровнем. Именно эти электроны определяют химические свойства атома металла. Внешний электронный уровень может быть заполнен разным числом электронов, что влияет на свойства металла.
Ядро и электроны взаимодействуют между собой с помощью электромагнитной силы. Протоны в ядре притягивают электроны, так как протоны имеют положительный заряд, а электроны - отрицательный. Это взаимодействие обеспечивает стабильность атома металла и его основные химические свойства.
Меньший внешний электронный уровень

Атомы металлов обладают особенностями в строении, которые делают их такими уникальными и полезными для различных приложений. Одна из таких особенностей - наличие меньшего внешнего электронного уровня.
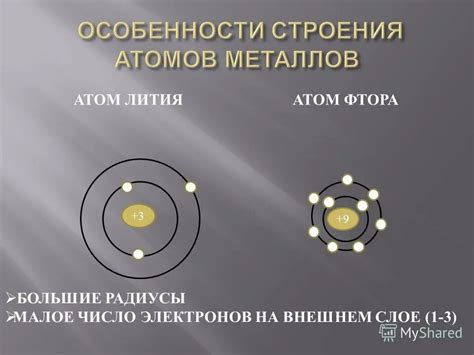
Меньший внешний электронный уровень у металлов объясняет их химическую активность. Внешний электронный уровень, или так называемая валентная оболочка, содержит электроны, которые могут участвовать в химических реакциях. В отличие от атомов неметаллов, у которых валентная оболочка содержит 4, 5 или 6 электронов, атомы металлов имеют всего 1, 2 или 3 электрона на внешнем уровне.
Это означает, что атомы металлов имеют большую склонность отдавать эти электроны другим атомам, образуя положительные ионы. Например, натрий (Na) имеет всего один электрон на внешнем электронном уровне. Поэтому в химических реакциях натрий очень легко отдаёт этот электрон, становясь ионом Na+. Это делает металлы отличными проводниками электричества и тепла.
Меньший внешний электронный уровень у металлов также приводит к их способности образовывать сильные металлические связи, что делает их твёрдыми и прочными материалами. Во внешнем электронном уровне металлов энергия связи между электронами и ядром сравнительно невелика, что способствует лёгкому переносу электронов и, как следствие, металлической проводимости. Это также обуславливает металлический блеск и способность металлов отражать свет.
Таким образом, меньший внешний электронный уровень является одной из основных особенностей строения атомов металлов, которая определяет их химическую активность и физические свойства.
Валентность и свойства металлов
Металлы – это химические элементы, обладающие определенными свойствами, в частности, высокой электропроводимостью и теплопроводностью. Эти свойства связаны с особенностями строения атомов металлов и их внешнего электронного уровня.
Внешний электронный уровень атомов металлов обычно содержит от одного до трех электронов. Такая конфигурация обуславливает их способность образовывать ионные соединения с неметаллами или сплавы с другими металлами.
Валентность металлов указывает на количество электронов, которые они могут отдать или принять при образовании химических связей. Обычно металлы обладают положительной валентностью и образуют катионы. Например, натрий (Na) имеет внешний электронный уровень 3s1 и может отдать один электрон, образуя катион Na+.
Свойства металлов, такие как хорошая электропроводимость, теплопроводность, пластичность и блеск, связаны с наличием свободных электронов. В металлах электроны делятся между атомами, образуя электронное облако, которое легко передает электрический ток и тепло.
Некоторые металлы обладают способностью образовывать сплавы с другими металлами. Сплавы – это смеси из двух или более металлов, которые обладают новыми свойствами. К примеру, сплав бронзы, состоящий из меди (Cu) и оловя (Sn), обладает повышенной твердостью и износостойкостью.
Металлическая связь и проводимость
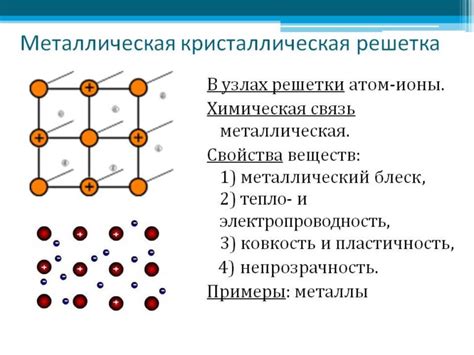
Металлическая связь - это особый тип химической связи между атомами в металлах, который обеспечивает их основные свойства - проводимость электричества и тепла, пластичность и блеск.
Основу металлической связи составляют свободные электроны, находящиеся во внешнем энергетическом уровне атомов металла. Эти электроны не принадлежат ни к одному конкретному атому, а свободно перемещаются по всей структуре металла. Именно благодаря этим электронам металлы обладают свойством проводимости электричества и тепла.
Межатомное расстояние в металлах обычно больше, чем в молекулах, что обусловливает их высокую пластичность. Электроны металла представляют собой своего рода "клей", который позволяет атомам свободно сдвигаться друг относительно друга без образования повреждений и разрушений структуры. Именно поэтому металлы обладают таким важным свойством, как пластичность.
Кроме того, наличие большого количества свободных электронов в металле обеспечивает его металлический блеск. Электроны атомов металла свободно взаимодействуют с электромагнитным излучением, что вызывает отражение света и создает блестящую поверхность металла.
Роль металлов в различных отраслях промышленности

Металлы играют важную роль во многих отраслях промышленности благодаря своим уникальным свойствам и структуре атомов. Они широко используются в машиностроении, электротехнике, строительстве, автомобилестроении и других областях.
Одно из главных преимуществ металлов - их высокая прочность и устойчивость. Благодаря этим свойствам они используются в машиностроении для создания деталей и конструкций, которые должны выдерживать высокие нагрузки. Кроме того, металлы обладают хорошей текучестью, что позволяет легко формировать из них различные изделия и обрабатывать их.
В электротехнике металлы используются для создания проводов, контактов, разъемов и других элементов электрических цепей. Благодаря высокой электропроводности металлы являются идеальным материалом для передачи электричества без потерь. Они также обладают хорошей теплопроводностью, что позволяет эффективно отводить тепло от электронных компонентов.
Строительная отрасль также широко использует металлы в своей деятельности. Металлические конструкции, такие как рамы зданий, балки, столбы и каркасы, обеспечивают прочность и надежность строений. Кроме того, металлы применяются и в отделочных работах, например, для изготовления оконных и дверных рам, вентиляционных систем и других элементов.
Металлы находят применение и в автомобилестроении, где они используются для создания кузовов, двигателей, колес и других деталей автомобилей. Их высокая прочность и легковесность позволяют улучшить экономичность и безопасность автомобилей. Кроме того, металлы обладают хорошей коррозионной устойчивостью, что особенно важно при эксплуатации автомобилей в различных климатических условиях.
Таким образом, металлы играют важную роль в различных отраслях промышленности благодаря своим уникальным свойствам, таким как прочность, электропроводность, термическая проводимость и коррозионная устойчивость. Их использование позволяет создавать надежные и эффективные изделия и конструкции, которые способны выдерживать высокие нагрузки и служить длительное время.
Вопрос-ответ

Каковы особенности строения атомов металлов?
Особенности строения атомов металлов заключаются в их электронной конфигурации. Атомы металлов имеют относительно большое количество электронов, которые распределены в нескольких энергетических уровнях. Кроме того, у атомов металлов обычно есть неполный внешний электронный уровень, что делает их реактивными и способными образовывать различные соединения и связи с другими атомами.
Почему внешний электронный уровень атомов металлов часто является неполным?
Внешний электронный уровень атомов металлов часто является неполным из-за специфической электронной конфигурации этих атомов. Металлы имеют малое количество электронов на своем внешнем энергетическом уровне, и ситуация, когда этот уровень заполнен полностью, встречается редко. Неполный внешний электронный уровень делает атомы металлов более реактивными и способными образовывать соединения с другими атомами.
Какие функции выполняет внешний электронный уровень атомов металлов?
Внешний электронный уровень атомов металлов выполняет несколько важных функций. Во-первых, он определяет химические свойства металлов и их способность образовывать соединения с другими атомами. Внешние электроны также отвечают за проводимость электричества и тепла в металлах. Кроме того, внешний электронный уровень может быть участвовать в образовании металлической связи, которая обеспечивает особую структуру и свойства металлов.
Почему металлы обладают хорошей электропроводностью?
Металлы обладают хорошей электропроводностью из-за особенностей строения атомов. Внешний электронный уровень атомов металлов обычно содержит свободные электроны, которые могут свободно перемещаться по кристаллической решетке металла. Это позволяет электрическому току проходить через металл без существенных сопротивлений. Более того, внешние электроны металла могут образовывать "электронное море", создавая особую металлическую связь, которая отличается от связей в других типах веществ.