Строение атомов металлов имеет свои особенности, одной из которых являются относительные размеры радиусов атомов. Радиус атома – это расстояние от его ядра до внешней электронной оболочки. При изучении данного вопроса можно выделить несколько особенностей в строении атомов металлов.
Во-первых, атомы металлов отличаются большим размером по сравнению с атомами неметаллов. Это связано с тем, что в металлических атомах на внешней электронной оболочке находится всего несколько электронов. При таком строении атома силы притяжения ядра к электронам существенно ослаблены, что позволяет электронам находиться на большем расстоянии от ядра.
Во-вторых, внутри атомов металлов присутствует так называемое "море электронов". Данный термин означает существование свободных электронов, которые двигаются по всему объему металла. Этот феномен объясняет множество свойств металлов, таких как электропроводность и теплопроводность.
Кроме того, атомы металлов имеют способность образовывать кристаллическую решетку, в которой каждый атом окружен соседними атомами, создавая таким образом металлическую сеть. Это обуславливает высокую пластичность и прочность металлов.
Таким образом, относительные размеры радиусов атомов металлов являются одной из особенностей их строения. Большой размер атомов, наличие свободных электронов и способность образовывать кристаллическую решетку делают металлы уникальными веществами с уникальными свойствами.
Радиусы атомов металлов и их значение
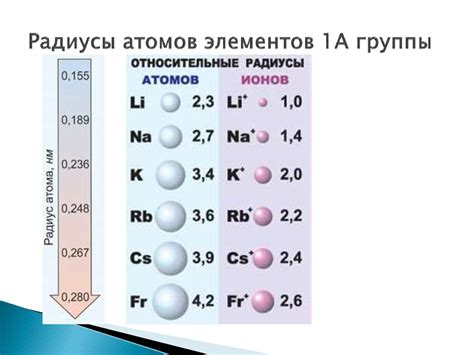
Радиусы атомов металлов являются важными свойствами, которые определяют множество их физических и химических характеристик. Размер атома металла может быть определен как расстояние от его ядра до наружного электрона, наиболее удаленного от ядра.
Все металлы имеют сравнительно большие радиусы атомов по сравнению с другими элементами в таблице Менделеева. Это связано с тем, что металлы имеют малое количество электронов в их внешней электронной оболочке, и эти электроны находятся далеко от заряженного ядра.
Наибольшие радиусы атомов обычно имеют металлы в самой нижней группе таблицы Менделеева, такие как калий (K), кальций (Ca) и барий (Ba). Они имеют наибольшее количество электронов в своих внешних электронных оболочках, что приводит к увеличению размера атомов.
Значение радиусов атомов металлов влияет на их химические свойства. Большой размер атома позволяет металлам образовывать ионные соединения с неметаллами, так как металл может отдать один или несколько электронов своей внешней оболочки и образовать положительно заряженный ион. Это обуславливает способность металлов к образованию солей и их реактивность в различных химических реакциях.
Таким образом, радиусы атомов металлов являются важными параметрами, которые определяют их физические и химические свойства. Большие радиусы атомов металлов обуславливают их способность образовывать ионные соединения и влияют на их реактивность в различных реакциях.
Влияние валентности на радиус атома металла

Радиус атома металла зависит от его валентности, то есть от количества электронов в внешней оболочке. Чем больше валентность, тем меньше радиус атома.
Валентность металлов определяется их способностью отдавать электроны при формировании химических связей. Чем выше валентность, тем больше электронов металл способен отдать.
Когда металл отдает электроны, его положительный заряд увеличивается, что приводит к сокращению его радиуса. Заряд ядра остается неизменным, но электроны внешней оболочки становятся меньше.
Следует отметить, что валентность металла может быть разной в разных химических соединениях. Некоторые металлы имеют переменную валентность, то есть способность отдавать разное количество электронов в зависимости от условий.
Таким образом, валентность металла оказывает прямое влияние на его радиус атома. Большая валентность приводит к уменьшению радиуса, а меньшая валентность – к увеличению. Это связано с изменением количества электронов во внешней оболочке и изменением положительного заряда ядра металла.
Тенденции в изменении размеров атомов металлов в периоде
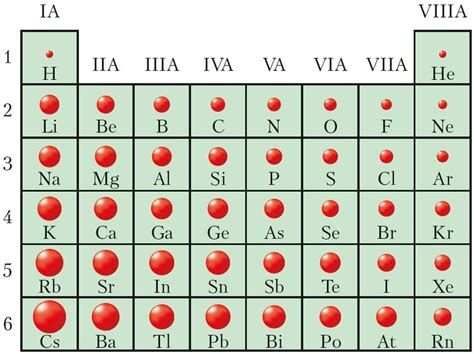
Периодическая система элементов предоставляет нам информацию о строении атомов и их свойствах, в том числе о размерах атомов металлов. Размеры атомов металлов в периоде изменяются по определенным закономерностям.
Обратим внимание на главные тенденции изменения размеров атомов металлов в периоде. Первое, что привлекает внимание - это увеличение размеров атома металла при движении от левого к правому краю периода. Это происходит из-за увеличения эффективного заряда ядра и уменьшения количества электронных оболочек, что позволяет атомам занимать более пространства.
Также важно отметить, что размеры атомов металлов в периоде уменьшаются с увеличением атомного номера, двигаясь от верхнего к нижнему краю периода. Это объясняется увеличением количества электронных оболочек в атоме, что делает его более расширенным и увеличивает его размеры.
Важным аспектом является также расположение в таблице элементов, образующих переходные металлы. Эти элементы имеют специфическую структуру внешних электронных оболочек, которая делает их размеры меньше, чем у предшествующих им элементов. Это объясняется тем, что внешние электроны этих элементов находятся в d-субуровне, которая имеет более компактную форму и не позволяет атому занимать большое пространство.
Итак, изменение размеров атомов металлов в периоде является комплексной и систематической закономерностью. Оно зависит от многих факторов, таких как эффективный заряд ядра, количество электронных оболочек и особенности строения внешних электронных оболочек. Учет этих тенденций позволяет лучше понять свойства металлов и их химическое поведение.
Тенденции в изменении размеров атомов металлов в группе

Размеры атомов металлов в группе элементов таблицы Менделеева демонстрируют определенные тенденции. Как правило, с увеличением атомного номера группы, радиус атомов металлов также увеличивается. Это объясняется тем, что количество электронных оболочек увеличивается по мере прохождения по группе, а каждая новая оболочка находится на большем расстоянии от ядра атома, что приводит к увеличению радиуса атома.
Однако есть некоторые исключения из этой общей закономерности. Например, в группе переходных металлов (группы с 3 по 12) радиусы атомов металлов практически не изменяются, так как электроны в этих атомах заполняют d-оболочку, которая находится ближе к ядру и сильнее притягивается к нему. Поэтому радиусы атомов переходных металлов остаются относительно стабильными.
Также стоит отметить, что внутри одной группы часто можно наблюдать тенденцию к увеличению радиуса атомов сверху вниз. Это происходит потому, что с каждым элементом в группе добавляется новая электронная оболочка, что приводит к увеличению радиуса. К примеру, в группе щелочных металлов (группа 1) радиусы атомов увеличиваются от лития до цезия.
В целом, знание о тенденциях в изменении размеров атомов металлов в группе позволяет лучше понять строение и свойства этих веществ. Размер атома металла имеет важное значение для объяснения его химической активности, электронной конфигурации и связей с другими атомами. Поэтому изучение этих тенденций является важной составляющей в химических исследованиях.
Сравнение размеров атомов металлов и неметаллов

Размеры атомов металлов и неметаллов являются одним из фундаментальных факторов, определяющих их физические и химические свойства. Радиус атома является мерой его размера и равен расстоянию от ядра до самого дальнего электрона. В целом, атомы металлов имеют большие радиусы по сравнению с атомами неметаллов.
Сравнивая размеры атомов, можно заметить, что основные металлы обладают наиболее большими атомами в периодической таблице элементов. Например, литий, натрий и калий имеют значительно большие размеры атомов по сравнению с элементами в их периоде. Это связано с наличием у них одного электрона в валентной оболочке и слабым экранированием его положительным зарядом ядра, что приводит к большим атомным радиусам.
Неметаллы, с другой стороны, имеют более маленькие атомы, так как они имеют наборы электронов, почти полностью заполняющих их валентные оболочки. Это приводит к сильному экранированию заряда ядра электронами внутренних оболочек и, как следствие, к уменьшению атомных радиусов.
Сравнение размеров атомов металлов и неметаллов важно для понимания их химической реактивности и способности образовывать химические связи. Большие атомы металлов, благодаря своей расположенности в периодической системе, имеют большую склонность к потере электронов и образованию катионов. Неметаллы, напротив, имеют маленькие атомы, что способствует их склонности к гain электронов и образованию анионов.
В целом, сравнение размеров атомов металлов и неметаллов помогает понять различия в их химических свойствах и электронной структуре, что является основой для понимания их роли в химических реакциях и важности в естественных и технических процессах.
Некомпактность атомов металлов
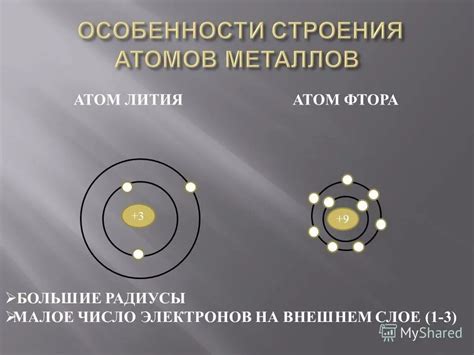
Атомы металлов характеризуются своей некомпактностью, что делает их уникальными в мире химии. В отличие от атомов неметаллов, атомы металлов имеют больший размер и несколько сложное строение.
Относительные размеры радиусов атомов металлов обусловлены их электронной конфигурацией. Атомы металлов имеют большое число электронов, расположенных в нескольких энергетических уровнях. Учитывая, что радиус атома связан с его электронной оболочкой, можно сказать, что атомы металлов имеют более крупные размеры.
Кроме того, электроны в атомах металлов располагаются в энергетических областях, называемых энергетическими зонами. В этих зонах электроны имеют свободу передвижения и могут образовывать электронные облака, которые дают металлам их специфические свойства.
Некомпактность атома металла влияет на его способность образовывать кристаллическую решетку, которая определяет его поведение в кристаллической фазе. Металлы обладают высокой теплопроводностью и электропроводностью, что объясняется наличием свободных электронов в их структуре. Кроме того, именно некомпактность атомов металлов делает их мягкими и пластичными, что позволяет им легко поддаваться различным физическим и химическим воздействиям.
Влияние строения атома на его физические и химические свойства

Строение атома имеет огромное значение для понимания его физических и химических свойств. В первую очередь, размер атома влияет на его реактивность и способность вступать в химические реакции. Большой радиус атома обеспечивает большую площадь поверхности и, соответственно, большее количество свободных электронов, что делает его более реакционноспособным.
Кроме того, строение атома определяет его электронную конфигурацию, которая влияет на его химические свойства. Например, атомы с полностью заполненными энергетическими уровнями обычно имеют малую реактивность, так как у них нет свободных электронов для взаимодействия с другими атомами.
Строение атома также может влиять на его физические свойства, такие как плотность, теплопроводность, электропроводность, и т.д. Например, атомы металлов обычно имеют большой размер и обладают свободными электронами, благодаря чему они обладают высокой теплопроводностью и электропроводностью.
Также строение атома может определять его способность к образованию ионов. Атомы металлов, имеющие небольшую энергию ионизации, легко теряют электроны и образуют положительно заряженные ионы. Это явление называется ионизацией. Ионы металлов обычно обладают повышенной реактивностью и способностью образовывать ионные соединения.
Вопрос-ответ

Какие особенности строения атомов металлов?
Атомы металлов имеют особую структуру, которая отличается от атомов других элементов. Основными особенностями строения атомов металлов являются наличие малого числа электронов в внешней оболочке и большого числа электронов во внутренних оболочках. Это позволяет металлам образовывать ионные сети и обладать металлическими свойствами, такими как хорошая теплопроводность и электропроводность.
Влияют ли электроны внешней оболочки на размер атомов металлов?
Да, электроны внешней оболочки играют важную роль в определении размера атомов металлов. Радиус атомов металлов определяется размером внешней оболочки и эффективным притяжением электронов ядра. Чем больше количество электронов в внешней оболочке, тем больший радиус имеют атомы металлов.
Каким образом атомы металлов образуют ионные сети?
Атомы металлов образуют ионные сети путем передачи электронов между соседними атомами. Это происходит из-за большого количества электронов во внутренних оболочках металлов. Атомы металлов отдают электроны в внешней оболочке другим атомам, чтобы достичь более стабильной конфигурации. Таким образом, образуется ионная сеть, состоящая из положительных и отрицательных ионов.
Какие факторы влияют на радиус атомов металлов?
Радиус атомов металлов зависит от нескольких факторов. Основным фактором является количество электронов в внешней оболочке. Чем больше электронов в внешней оболочке, тем больший радиус имеют атомы металлов. Также влияет эффективное притяжение электронов ядра, которое зависит от заряда ядра и количества оболочек электронов.
