Металлы — это класс веществ, обладающих высокой теплопроводностью и электропроводностью, а также обладающих блеском и свойством оставаться твердыми при обычных условиях. Одним из важных аспектов, определяющих свойства и характеристики металлов, является их атомное строение.
Атом металла состоит из ядра и облака электронов, при этом ядро содержит протоны и нейтроны, а наружные оболочки атома занимают электроны. Важно отметить, что на последнем энергетическом уровне атома металла всегда находится определенное число электронов, которое определяет его химические свойства.
Количество электронов на последнем энергетическом уровне определяет восприимчивость металла к химическим реакциям и его способность образовывать соединения. Как правило, атомы металлов стремятся заполнить свою внешнюю оболочку электронами, чтобы достичь более устойчивого состояния. Поэтому большинство металлов имеют 1, 2 или 3 электрона на последнем энергетическом уровне.
Например, у атома натрия (Na) есть всего один электрон на последнем энергетическом уровне. Это делает его очень реакционноспособным, поскольку он готов отдать этот электрон и образовать ион положительного заряда.
Знание числа электронов на последнем энергетическом уровне позволяет установить положение элемента в таблице химических элементов и предсказать его свойства. Кроме того, это также определяет способность атома металла образовывать ковалентные и ионные связи с другими элементами.
Строение атомов металлов
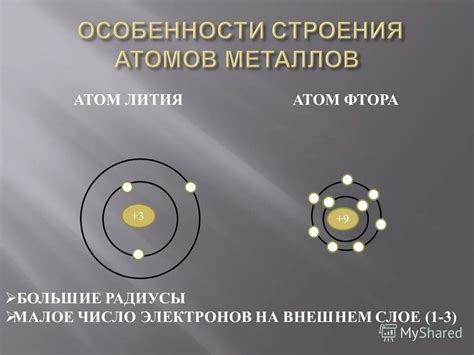
Строение атомов металлов определяется их электронной оболочкой. Атомы металлов состоят из ядра и облака электронов, которые находятся по разным уровням энергии.
Ядро атома металла состоит из протонов и нейтронов, обладающих положительным зарядом. Протоны имеют массу и определяют химические свойства элемента. Нейтроны не имеют заряда и отвечают за стабильность ядра.
Оболочка атома металла состоит из электронов, которые движутся по орбитам вокруг ядра. Уровни энергии электронов расположены на определенных расстояниях от ядра и называются энергетическими уровнями или оболочками.
На последнем энергетическом уровне находятся валентные электроны, которые определяют химические свойства металлов. У металлов валентные электроны могут быть одной, двух или трех валентностью, что позволяет им образовывать различные химические соединения.
Строение атомов металлов с определенным числом валентных электронов определяет их способность к образованию межатомных связей и обеспечивает особые свойства, такие как хорошая электропроводность, теплопроводность и пластичность.
Атом и его составные части
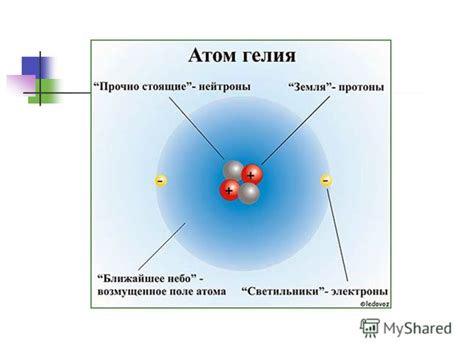
Атом - это базовая единица строения вещества. Он состоит из трех основных частей: ядра, электронов и электронных оболочек.
Ядро - это центральная часть атома, которая содержит положительно заряженные протоны и нейтроны. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда вообще. Ядро является очень плотным и стабильным, именно он определяет химические и физические свойства атома.
Электроны - это отрицательно заряженные элементарные частицы, которые движутся вокруг ядра на электронных оболочках. Электроны имеют очень маленькую массу по сравнению с протонами и нейтронами, но играют важную роль в определении химических свойств вещества.
Электронные оболочки - это области пространства, где движутся электроны. Они расположены на различных энергетических уровнях, которые могут быть представлены в виде оболочек или орбит вокруг ядра. Первая электронная оболочка ближе всего к ядру и может содержать до 2 электронов, вторая - до 8 электронов, а третья - до 18 электронов. Количество электронов на последнем энергетическом уровне определяет химические связи и реактивность атома.
В зависимости от количества электронов на последнем уровне, атомы металлов могут образовывать ионы, теряя или получая электроны. Это позволяет им образовывать химические связи и обладать различными физическими и химическими свойствами.
Электронные оболочки и ядра

Атомы металлов состоят из ядер и электронных оболочек. В центре атома находится ядро, которое содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Общее число протонов в ядре определяет атомный номер элемента и характеризует его химические свойства.
Вокруг ядра находятся электронные оболочки, которые содержат электроны. Электроны имеют отрицательный заряд и движутся по орбитам вокруг ядра. Количество электронов в каждой оболочке разное и определяется энергетическим уровнем. Основные энергетические уровни обозначаются числами от 1 до 7, при этом уровни с более высоким номером находятся дальше от ядра и имеют большую энергию.
На последнем энергетическом уровне находятся внешние электроны, которые называются валентными электронами. Эти электроны обладают наибольшей свободой движения и определяют химические свойства металлов. Число валентных электронов может быть разным для разных элементов. Например, у натрия на последнем энергетическом уровне находится 1 валентный электрон, а у кальция - 2 валентных электрона.
Число электронов на последнем уровне
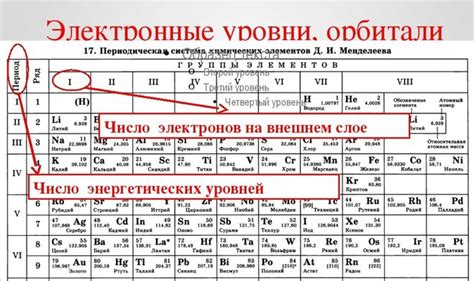
Число электронов на последнем энергетическом уровне, также известном как валентный энергетический уровень, играет важную роль в характеристике поведения атомов металлов. Валентные электроны находятся в наиболее удаленной области от ядра, и именно они определяют химические свойства атомов металлов.
Для большинства металлов число электронов на последнем уровне обычно составляет одну или две единицы. Это связано с тем, что атомы металлов стремятся достичь электронной конфигурации инертных газов – иметь полностью заполненный s- или p-подуровень на последнем энергетическом уровне.
Например, у металла натрия в атоме 11 электронов, из которых два находятся на последнем энергетическом уровне – 3s. При реакции натрия с другими элементами эти два электрона могут быть переданы или разделены с целью достижения электронной конфигурации инертного газа неона.
Число электронов на последнем уровне позволяет определить, как элемент может вступать в химические реакции и образовывать соединения. Это также важно при рассмотрении физических свойств металлов, таких как проводимость электричества и тепла, а также пластичность и хрупкость.
Понятие о валентности

Валентность - это химическая характеристика атома металла, обозначающая количество электронов, которые может отдать или принять атом при образовании химических связей. Валентность влияет на химические свойства металлов и их способность образовывать соединения.
Валентность атома металла определяется числом электронов на его последнем энергетическом уровне. Атомы металлов стремятся отдать или принять электроны, чтобы достичь стабильной конфигурации, например, заполнить свой внешний энергетический уровень или удалить его. В результате такой обмен электронами образуются ионы, которые обладают определенной валентностью.
Валентность атома металла может быть положительной или отрицательной, в зависимости от того, сколько электронов атом отдал или принял. Положительная валентность свидетельствует о том, что атом отдал электроны и стал положительным ионом, негативная валентность указывает на то, что атом принял дополнительные электроны и стал отрицательным ионом.
Знание валентности металла помогает понять, какие типы химических связей могут быть образованы с другими элементами. Например, если валентность металла составляет 2, то он может образовывать соединения с элементами, имеющими валентность -2, такие связи называются ионными. Если валентность металла и других элементов одинакова, то образуется химическая связь с общими электронами, такими связами можно назвать координационные соединения.
Группы в периодической системе элементов
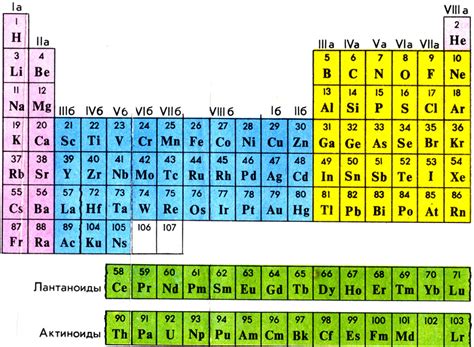
Периодическая система элементов состоит из 18 групп, расположенных по вертикали. Группы представляют собой столбцы элементов и обозначаются числами от 1 до 18. Каждая группа имеет свою особенность, связанную с количеством электронов на последнем энергетическом уровне.
Главная характеристика группы - число электронов на последнем энергетическом уровне, которое определяет химические свойства элементов этой группы. Например, элементы первой группы - щелочные металлы имеют один электрон на последнем энергетическом уровне и проявляют сильную активность, образуя ион положительного заряда при реакции с водой или кислотами.
Вторая группа - щелочноземельные металлы, имеют два электрона на последнем энергетическом уровне и также обладают активностью, но меньшей, чем у щелочных металлов. Этот закономерный ряд можно продолжать по всем группам периодической системы.
Кроме числа электронов на последнем энергетическом уровне, группы в периодической системе могут иметь и другие общие особенности. Например, элементы группы 18 называют благородными газами, так как они обладают высокой инертностью и практически не вступают в химические реакции. Элементы групп 3-12 называют переходными металлами и они обладают способностью образовывать соединения с различными степенями окисления.
Группы в периодической системе элементов представляют собой удобное средство для классификации и систематизации химических элементов. Изучение химических свойств элементов каждой группы позволяет лучше понять причины их реакционной активности и взаимодействия с другими веществами.
Связь между числом электронов и свойствами металлов

Число электронов на последнем энергетическом уровне атома металла имеет прямую связь с его свойствами. Эти электроны, также называемые валентными, определяют химическое и физическое поведение металла в реакциях и в процессе формирования соединений.
Чем меньше число электронов на последнем уровне, тем больше металл подвергается окислению, образуя ионы положительного заряда. Это связано с тем, что металл стремится отдать свои валентные электроны, чтобы достичь электронной конфигурации с полной оболочкой.
Количество валентных электронов также влияет на химическую активность металла. Металлы с большим числом валентных электронов имеют большую склонность к реакциям и образованию соединений с другими элементами. Например, металлы с одним валентным электроном, такие как литий или натрий, легко реагируют с водой или кислородом, образуя соответственно гидроксид или оксид.
Также валентные электроны играют важную роль в электропроводности металлов. Они свободно двигаются в структуре металлической решетки, что позволяет металлам быть хорошими проводниками тепла и электричества. Чем больше валентных электронов, тем лучше металл проводит электричество и тепло.
Таким образом, число электронов на последнем уровне атома металла является важным фактором, определяющим его химические и физические свойства. Это число влияет на способность металла реагировать с другими элементами, его электропроводность и его склонность к окислению.
Вопрос-ответ

Что такое атомы металлов?
Атомы металлов - это микроскопические частицы, из которых состоят металлы. Атомы металлов имеют положительно заряженное ядро, окруженное облаком отрицательно заряженных электронов. Эти атомы объединяются в кристаллическую решетку, образуя металлический материал.
Каково строение атомов металлов?
Строение атомов металлов включает в себя ядро, состоящее из протонов и нейтронов, и облако электронов, которое окружает ядро. Атомы металлов имеют типичную сферическую форму, где ядро находится в центре, а электроны располагаются вокруг него на разных энергетических уровнях или орбитах.
Что такое последний уровень электронов?
Последний уровень электронов - это энергетический уровень, на котором находятся электроны во внешней оболочке атома. Этот уровень называется также валентным уровнем и определяет химические свойства атома и возможность образования химических соединений.
Сколько электронов на последнем уровне имеют атомы металлов?
Атомы металлов могут иметь разное число электронов на последнем уровне, в зависимости от своего положения в таблице Менделеева. Например, металлы в первой группе (щелочные металлы) имеют один электрон на последнем уровне, металлы во второй группе (щелочноземельные металлы) имеют два электрона, а металлы в шестой группе (железо, марганец) имеют шесть электронов на последнем уровне.
Какое значение имеет число электронов на последнем уровне для химических свойств металлов?
Число электронов на последнем уровне имеет важное значение для химических свойств металлов. Это число определяет, сколько электронов может атом металла отдать или принять при взаимодействии с другими атомами. Чем меньше число электронов на последнем уровне, тем больше металл будет стремиться отдать электроны, образуя положительный ион. Такие металлы обычно являются хорошими проводниками электричества и тепла.
