Атомы металлов главных подгрупп представляют собой организованную структуру, которая определяет их химические и физические свойства. В отличие от атомов неметаллов, у которых электроны окружают заряд ядро непрерывно, атомы металлов имеют особую структуру, которая делает их особо эффективными проводниками электричества и тепла.
Главной особенностью строения атомов металлов главных подгрупп является наличие свободных электронов в валентной оболочке. Валентная оболочка представляет собой наиболее внешнюю оболочку атома, в которой находятся электроны, участвующие в химических реакциях. У атомов металлов она обычно содержит от одного до трех электронов, которые легко могут двигаться между атомами, образуя общую электронную облако.
Эти свободные электроны играют важную роль во многих свойствах металлов, таких как электропроводность, теплопроводность, пластичность и металлический блеск. Они формируют так называемую "море электронов", которое позволяет силам притяжения между атомами металла легко преодолевать их отталкивающие силы, что обуславливает способность металлов быть деформируемыми без разрушения структуры.
Устройство атома металла
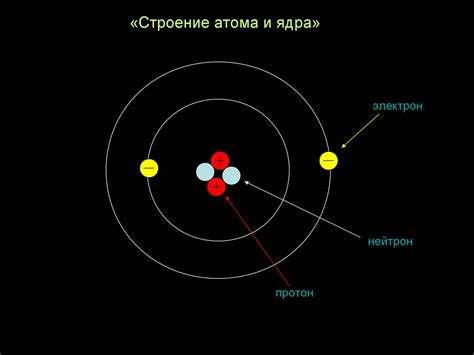
Атом металла представляет собой положительно заряженное ядро, окруженное облаком отрицательно заряженных электронов. Основную массу ядра составляют протоны и нейтроны, причем протоны несут положительный заряд, а нейтроны не имеют заряда.
Наиболее важная особенность атомов металлов заключается в их электронной конфигурации. Обычно внешние электроны, которые определяют химические свойства элемента, находятся в достаточно удаленной области от ядра, в так называемом валентном энергетическом уровне. Именно благодаря этому металлы обладают возможностью образовывать ионные или ковалентные соединения с другими элементами.
У атомов металлов также есть особенность - наличие свободных электронов. В металлах электроны в валентной области образуют так называемую зону проводимости, в которой электроны могут свободно двигаться. Это объясняет высокую электропроводность металлов. Помимо этого, металлы отличаются высокой теплопроводностью и возможностью образования кристаллической решетки.
Таким образом, устройство атома металла отличается наличием положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Внешние электроны находятся на далеком от ядра энергетическом уровне и определяют химические свойства металла. Металлы также имеют свободные электроны в зоне проводимости, что обуславливает их высокую электропроводность, теплопроводность и кристаллическую структуру.
Состав и строение
Состав атомов металлов главных подгрупп определяется их положением в периодической таблице. Каждый атом металла состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, а электронная оболочка состоит из электронов, которые движутся по определенным орбитам вокруг ядра.
Приближенно можно сказать, что атомы металлов главных подгрупп имеют следующую общую структуру. Внутри ядра находятся протоны, положительно заряженные частицы, и нейтроны, нейтрально заряженные частицы. Количество протонов в ядре определяет атомный номер элемента и его электронную конфигурацию. Вокруг ядра движется облако электронов - отрицательно заряженных частиц. Количество и энергетические уровни электронов также определяют свойства и химическое поведение металлов главных подгрупп.
Строение атомов металлов главных подгрупп важно, так как от него зависят их свойства. Например, металлы обладают высокой электропроводностью и теплопроводностью благодаря наличию свободных электронов в электронной оболочке. Кроме того, строение атомов металлов главных подгрупп может влиять на их способность образовывать соединения с другими элементами и взаимодействовать с ними.
Электронная оболочка атома

Электронная оболочка атома представляет собой зоны наличия электронов, расположенные вокруг ядра. Она состоит из электронных орбиталей, которые разделены на энергетические уровни. На каждом уровне может находиться определенное количество электронов.
Основные энергетические уровни обозначаются целыми числами от 1 до 7. Первый уровень может содержать не более 2 электронов, второй - не более 8, а на третьем уровне могут разместиться до 18 электронов.
В основном энергетическом уровне находятся субуровни, обозначающие подуровни энергии. Субуровни идентифицируются буквами s, p, d и f.
На каждом субуровне может находиться разное количество электронов. Например, на s-субуровне может разместиться только 2 электрона, на p-субуровне - 6 электронов, на d-субуровне - 10 электронов, а на f-субуровне может разместиться до 14 электронов.
Таким образом, электронная конфигурация атома главных подгрупп металлов определяет количество электронов на каждом энергетическом и субуровневом уровне. Это важно для понимания их структуры и химических свойств.
Главные подгруппы металлов

Металлы - это элементы, обладающие высокой электропроводностью, блеском, и способностью образовывать ионы положительного заряда. Они играют важную роль в промышленности и науке благодаря своим уникальным свойствам.
Главные подгруппы металлов включают алкалийные металлы (1-ая главная подгруппа) и щелочноземельные металлы (2-ая главная подгруппа). Оба типа металлов характеризуются высокой активностью и химической реактивностью.
Алкалийные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают низкими плотностью и температурой плавления, и реагируют с водой, образуя щелочные растворы. Алкалийные металлы широко используются в производстве батареек, сплавов и взрывчатых веществ.
Щелочноземельные металлы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они имеют высокую плотность и высокую температуру плавления. Щелочноземельные металлы также реагируют с водой, но менее активно, по сравнению с алкалийными металлами. Они часто используются в производстве сплавов, солнечных батарей и других электронных устройств.
Как алкалийные, так и щелочноземельные металлы имеют один электрон в внешней оболочке и имеют тенденцию образовывать однозарядные положительные ионы. Однако, наличие дополнительных электронов в внешней оболочке ущемляет их активность и способность к реакциям.
Особенности 1-й главной подгруппы

1-я главная подгруппа включает элементы, у которых внешний электронный слой состоит из 1 электрона. В эту группу входят литий (Li), натрий (Na), калий (K) и другие металлы.
В атомах металлов 1-й главной подгруппы на внешнем энергетическом уровне находится один электрон. Это делает их очень реакционноспособными элементами. Они стремятся отдать этот электрон, чтобы достичь электронной конфигурации инертного газа. В процессе реакции они образуют положительные ионы, легко обмениваются электронами и образуют ионные соединения.
1-я главная подгруппа также характеризуется низкими температурами плавления и кипения. Это связано с наличием всего одного электрона во внешнем энергетическом слое, который слабо удерживается атомом. Поэтому уже при невысоких температурах эти атомы начинают легко двигаться и переходить в состояние жидкости или газа.
Также стоит отметить, что металлы 1-й главной подгруппы обладают высокой термической и электрической проводимостью. Это происходит благодаря свободным электронам в их структуре, которые легко двигаются под воздействием внешнего электрического поля или тепловой энергии.
Вопрос-ответ

Как строится атом металла главной подгруппы?
Атом металла главной подгруппы состоит из ядра, в котором располагаются протоны и нейтроны, и электронной оболочки, на которой находятся электроны. Ядро атома заряжено положительно, а электроны имеют отрицательный заряд и обращаются вокруг ядра по определенным энергетическим уровням.
Какие есть особенности строения атомов металлов главной подгруппы?
Одной из особенностей строения атомов металлов главной подгруппы является наличие большого количества электронов на последнем энергетическом уровне. Это обуславливает их высокую химическую активность и способность образовывать ионы положительной валентности. Также атомы металлов главной подгруппы обладают большим размером и являются хорошими проводниками электричества и тепла.
От чего зависит химическая активность атомов металлов главной подгруппы?
Химическая активность атомов металлов главной подгруппы зависит от количества электронов на их последнем энергетическом уровне. Чем больше электронов на последнем уровне, тем выше химическая активность. Это связано с тем, что атомы стремятся заполнить свой последний энергетический уровень полностью или обретать электронную конфигурацию инертного газа.
Почему атомы металлов главной подгруппы являются хорошими проводниками электричества и тепла?
Атомы металлов главной подгруппы являются хорошими проводниками электричества и тепла благодаря свободным электронам на их последнем энергетическом уровне. Эти электроны могут свободно двигаться по металлической решетке и передавать электрический заряд или тепловую энергию от одной частицы к другой.
