Атом является основным строительным блоком вещества и имеет сложную структуру. В атоме металлов число электронов на внешнем энергетическом уровне играет важную роль. Этот уровень, называемый также валентным уровнем, определяет химические свойства атома металла.
Валентный уровень металла содержит электроны, которые участвуют в химических реакциях и образуют связи с другими атомами. Количество электронов на внешнем уровне определяет важные свойства металлов, такие как их активность и способность образовывать соединения с другими элементами. Чем больше электронов на внешнем уровне, тем более активен металл.
Кроме того, радиус атома металла также влияет на его свойства. Радиус атома определяет размер металлического кристалла и его физические свойства, такие как плотность, теплопроводность и электропроводность. В общем, атомы металлов имеют больший размер и радиус по сравнению с атомами неметаллов.
Исследование особенностей строения атомов металлов, включая число электронов на внешнем уровне и радиус атома, позволяет лучше понять и объяснить химические и физические свойства металлов.
В дальнейшем исследовании особенностей строения атомов металлов может быть полезным для разработки новых материалов и нахождения их применения в различных отраслях науки и промышленности.
Строение атомов металлов: число электронов на внешнем уровне

Строение атомов металлов определяется их электронной конфигурацией, а именно распределением электронов по энергетическим уровням и подуровням. Особенностью атомов металлов является наличие внешнего энергетического уровня, который содержит от одного до нескольких электронов. Именно эти электроны определяют химические свойства металлов и их взаимодействие с другими веществами.
Число электронов на внешнем уровне атомов металлов варьирует в зависимости от их положения в периодической таблице. Например, у щелочных металлов, таких как литий, натрий и калий, на внешнем уровне находится один электрон. Это делает их очень реактивными, поскольку они стремятся отдать этот электрон и образовать положительный ион.
У большинства металлов на внешнем энергетическом уровне находится от одного до двух электронов. Например, у железа и меди на внешнем уровне находятся два электрона, что обуславливает их способность к образованию различных валентностей и образованию соединений с разными элементами.
Также существуют переходные металлы, которые имеют переменную валентность и на внешнем уровне могут содержать разное число электронов. Например, хром может иметь валентности +2, +3 и +6, и в зависимости от этого может образовывать соединения с разными элементами.
Наличие электронов на внешнем уровне является одной из основных особенностей строения атомов металлов и определяет их химические свойства и способность образовывать химические связи с другими элементами.
Внешний уровень электронов атома металла

Внешний уровень электронов атома металла играет важную роль в определении его химических и физических свойств. Этот уровень, также известный как валентный уровень, содержит электроны, которые находятся на наиболее удаленной от ядра области энергетической оболочки атома металла. Электроны на внешнем уровне обычно образуют химические связи с другими атомами.
Число электронов на внешнем уровне атома металла определяется его электронной конфигурацией. Металлы, находящиеся в главной и переходных группах таблицы Менделеева, имеют внешний уровень, содержащий от одного до двух электронов. Соответственно, эти металлы обладают свойствами легко отдавать свои внешние электроны при образовании ионов или химических связей.
Радиус атома металла также зависит от его внешнего уровня электронов. Обычно радиус атома увеличивается по мере движения от верхнего левого угла таблицы Менделеева к нижнему правому. Это связано с увеличением числа энергетических уровней и распределением электронов по большей площади. Больший радиус атома металла делает его более подвижным и способным образовывать металлическую решетку, что объясняет его высокую проводимость тепла и электричества.
Число электронов на внешнем уровне

Атомы металлов имеют особенности в строении своих электронных оболочек. Наиболее значимым параметром для определения химических свойств металлов является число электронов на их внешнем энергетическом уровне - валентной оболочке.
Валентные электроны - это электроны, которые находятся на самом высоком энергетическом уровне атома металла и являются ответственными за обмен электронами при химических реакциях. Количество валентных электронов определяет химические свойства металлов, такие как их активность, способность образовывать ионы и соединения.
Наиболее типичным числом валентных электронов для металлов является 1, 2 или 3 . Это происходит потому, что атомы металлов часто предпочитают передавать свои электроны другим атомам, чтобы достичь более устойчивой конфигурации энергетических уровней.
Количество валентных электронов также связано с положением металла в периодической системе. Химические элементы, расположенные ближе к левому краю периодической таблицы (например, щелочные и щелочноземельные металлы), имеют меньше валентных электронов, чем элементы, расположенные ближе к правому краю (например, металлы переходных групп).
Знание числа электронов на внешнем уровне позволяет лучше понять свойства металлов и использовать их в различных областях, таких как производство материалов, электротехника и химическая промышленность.
Строение атомов металлов: радиус атома

Радиус атома – это расстояние от центра атома до его внешней электронной оболочки. Размер атома определяется величиной его радиуса, который может варьироваться в зависимости от типа химического элемента. Для металлов характерно особое строение атомов, что влияет на их радиус.
Металлы отличаются от других элементов тем, что у них на внешнем энергетическом уровне находится небольшое количество электронов, обычно один или два. Это основное отличие от неметаллов, у которых внешний энергетический уровень может содержать от 5 до 8 электронов.
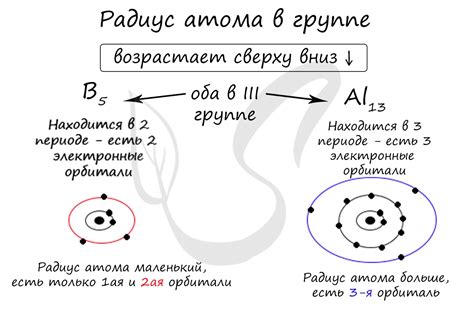
Радиус атома металла зависит от его положения в таблице элементов. Внутри каждой группы металлы имеют постепенно увеличивающийся радиус атомов от верхушки группы к основанию. Столь значительные различия в радиусе атомов связаны с наличием электронных оболочек разного размера.
Чаще всего радиус атома металла можно определить экспериментально по результатам рентгеноструктурного анализа. С помощью рентгеновской дифракции на атомных решетках можно определить расстояние между атомами, а в дальнейшем вычислить радиус атома.
Размер атома металла имеет прямое влияние на его физические свойства. Большие атомы имеют слабую связь между собой и обладают низкой температурой плавления и кипения. Маленькие атомы, наоборот, обладают сильными связями и высокими температурами плавления и кипения.
Радиус атома и его значение
Радиус атома представляет собой меру размеров атома, т.е. расстояние от его ядра до внешней электронной оболочки. Он играет важную роль в химических и физических свойствах элементов.
Размер атомов металлов обычно относительно большой. Это объясняется тем, что металлы имеют небольшое количество электронов на внешнем уровне, что обеспечивает слабую силу притяжения между электронами и ядром. Это также позволяет металлам образовывать металлические связи и обладать характерными механическими и электрическими свойствами.
Связь между радиусом атома и его металлическими свойствами заключается в том, что большой радиус атома позволяет атомам металлов образовывать сильные металлические связи и, следовательно, обладать высокой теплопроводностью и электропроводностью. Кроме того, большой радиус атома металла позволяет атомам легко перемещаться и сдвигаться друг относительно друга, что обусловливает пластичность и обработку металлов.
Значение радиуса атома также связано с положением элемента в периодической системе. В пределах одного периода, радиус атома обычно увеличивается слева направо, так как количество протонов и электронов в атоме увеличивается. В пределах одной группы, радиус атома обычно увеличивается сверху вниз, так как количество электронных оболочек увеличивается.
В общем, понимание радиуса атома металла является важной составляющей для понимания его свойств и влияния на химические реакции и реактивность элементов.
Вопрос-ответ

Что такое число электронов на внешнем уровне атома металла?
Число электронов на внешнем уровне атома металла - это количество электронов, находящихся на самом внешнем энергетическом уровне атома. Оно играет важную роль в химических реакциях и определяет химические свойства металла.
Какое значение имеет число электронов на внешнем уровне атома металла?
Значение числа электронов на внешнем уровне атома металла указывает на то, сколько электронов может быть переключено или передано во время химических реакций. Это число также позволяет определить группу, в которую входит металл в периодической таблице.
Как связано число электронов на внешнем уровне атома металла с его химическими свойствами?
Число электронов на внешнем уровне атома металла определяет его химические свойства, так как они определяют способность металла образовывать химические связи с другими атомами. Металлы с небольшим числом электронов на внешнем уровне склонны образовывать катионы, а металлы с большим числом электронов на внешнем уровне склонны образовывать отрицательно заряженные ионы - анионы.
Как размер атомов металлов связан с числом электронов на внешнем уровне?
Размер атомов металлов обычно увеличивается с увеличением числа электронов на внешнем уровне. Это происходит из-за увеличения электростатического отталкивания между электронами на внешнем уровне и ядром атома. Как результат, атом становится более объемным, и радиус атома увеличивается.
Какие особенности строения атомов металлов влияют на их радиус?
Радиус атома металла зависит от нескольких особенностей его строения. Важными факторами являются количество электронных оболочек и эффективность экранирования электронами внутренних оболочек. Количество электронных оболочек и эффективность экранирования влияют на силу притяжения ядра атома к его электронному облаку, определяя тем самым радиус атома.
