Атомы металлов представляют особый интерес для изучения, так как они обладают уникальными свойствами и важны для различных отраслей промышленности. Каждый металл состоит из атомов, которые в свою очередь состоят из электронов, находящихся вокруг ядра. Ядро атома металла состоит из протонов и нейтронов, а свободные электроны образуют электронное облако.
Важной особенностью атомов металлов является наличие внешней электронной оболочки, которая содержит один или несколько электронов. Эти электроны находятся на относительно большом удалении от ядра и делятся между атомами в кристаллической решетке металла. Это позволяет металлам быть хорошими проводниками электричества и тепла.
Для металлов характерна также особенность, называемая металлической связью. Между атомами металла действует силовое поле, создаваемое электрическим зарядом ядер и электронов. Это поле стабилизирует электронное облако и позволяет атомам металла быть твердыми и прочными.
Особенности строения атомов металла являются основой для объяснения многих свойств и применений металлов в нашей жизни. Изучение строения атомов металлов помогает ученикам понять, почему металлы обладают высокой проводимостью электричества, отличаются высокой пластичностью и прочностью, а также находят применение в различных отраслях промышленности.
Необычное строение атомов металлов
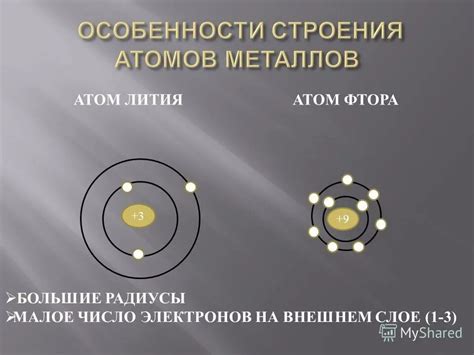
Атомы металлов отличаются особым строением, которое делает их особенно устойчивыми и способными к образованию кристаллической решетки. Главная особенность атомов металла состоит в наличии у них свободных электронов, которые могут перемещаться между атомами и образовывать межатомные связи.
Оболочка атома металла может состоять из нескольких энергетических уровней или областей, содержащих электроны разных энергий. Наиболее удаленная область, которую называют валентной оболочкой, содержит валентные электроны, которые принимают активное участие в химических реакциях.
Количество валентных электронов в атоме металла может быть разным и определяет его химические свойства. Общим для многих металлов является наличие одного или нескольких свободных электронов в валентной оболочке, которые образуют так называемый "электронный облак". Этот электронный облак окружает положительно заряженное ядро атома металла, состоящее из протонов и нейтронов.
Электроны в "электронном облаке" металла могут двигаться свободно внутри кристаллической решетки. Благодаря этому свойству металлы обладают хорошей проводимостью электричества и тепла. Также электроны металлов отвечают за их блеск и металлический цвет.
Влияние внешней оболочки
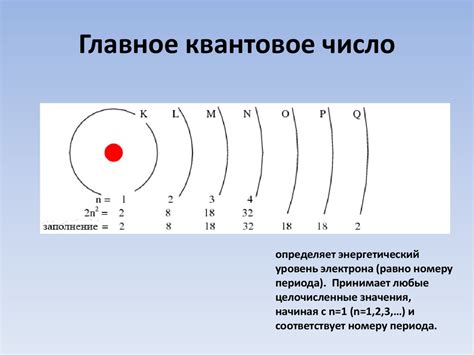
Внешняя оболочка атома металла играет важную роль в его химических и физических свойствах. Она состоит из энергетических уровней или орбиталей, на которых располагаются электроны. Количество электронов в внешней оболочке определяет валентность атома, то есть его способность принимать или отдавать электроны при химических реакциях.
Влияние внешней оболочки на свойства металла проявляется в его электропроводности и пластичности. Валентные электроны, находящиеся в внешней оболочке, свободно движутся по металлической решетке, создавая электронную оболочку. Это обуславливает хорошую электропроводность металлов, так как электронные оболочки металлов могут образовывать связи с другими атомами под действием электрического поля.
Кроме того, внешняя оболочка влияет на пластичность металла. Возможность электронов передвигаться свободно в решетке металла снижает его жёсткость и делает его податливым к деформации. Практически все металлы обладают высокой пластичностью и способны к изменению формы под воздействием давления или теплового воздействия.
Электронная структура и свойства

Атомы металлов обладают особенной электронной структурой, которая определяет их уникальные свойства. В зависимости от количества электронов во внешней оболочке металлы могут образовывать широкий спектр химических соединений и проявлять разные физические свойства.
Одной из ключевых особенностей электронной структуры атомов металлов является наличие свободных электронов в их внешней оболочке. Эти свободные электроны способны свободно перемещаться по кристаллической решетке металла и создавать электрический ток. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью.
Также электронная структура атомов металлов обуславливает их способность образовывать ионы положительного заряда. При отдельном атоме металл имеет нейтральный заряд, но при взаимодействии с другими атомами может отдавать один или несколько электронов, превращаясь в ион. Это позволяет металлам образовывать соли и способствует их химической активности.
Кроме того, электронная структура металлов влияет на их магнитные свойства. Некоторые металлы обладают постоянным магнитным моментом благодаря наличию непарных электронов в их внешней оболочке. Это явление называется ферромагнетизмом. Другие металлы могут обладать только временным магнитным моментом, который появляется под воздействием внешнего магнитного поля.
Кристаллическая решетка металлов
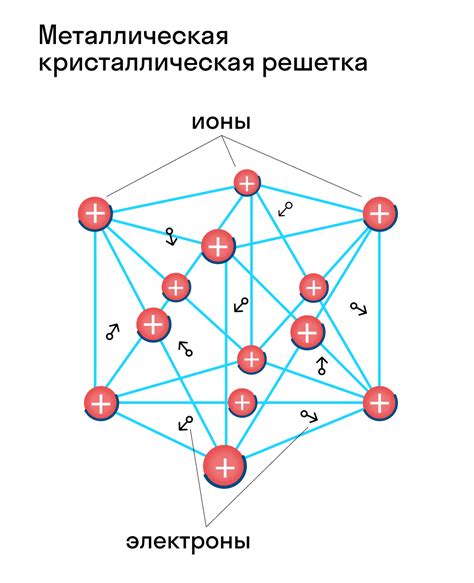
Кристаллическая решетка является основой структуры металлов и определяет их физические и химические свойства. В отличие от аморфной структуры, кристаллическая решетка обладает строго упорядоченным расположением атомов.
В кристаллической решетке металлов все атомы расположены в особых точках кристаллической решетки, называемых узлами. Узлы делятся на три типа: узлы простейшей кубической решетки, узлы центрированной кубической решетки и узлы гранецентрированной кубической решетки.
Узлы образуют элементарную ячейку, которая повторяется в пространстве, образуя кристаллическую решетку металла. Структура кристаллической решетки влияет на физические свойства металлов, например, их плотность, теплопроводность и электропроводность.
Кристаллическая решетка металлов также обладает изотропностью, то есть свойством быть одинаковой во всех направлениях. Это обусловлено равновероятным распределением атомов в решетке и их способностью перемещаться без изменения структуры решетки.
Вопрос-ответ

Какие особенности строения атомов металла важны для урока в 9 классе?
Основные особенности строения атомов металла, важные для урока в 9 классе, включают наличие ядра атома, в котором находятся протоны и нейтроны, и облака электронов, образующегося вокруг ядра. Также стоит обратить внимание на структуру электронных оболочек атома и функции электронов в металле.
Какова роль электронов в строении атома металла?
Электроны играют очень важную роль в строении атома металла. Они образуют облако электронов, окружающее ядро атома, и образуют электронные оболочки. Электроны могут перемещаться между оболочками и ядром, что определяет свойства металла, такие как проводимость электричества и тепла.
Какие еще особенности строения атомов металла можно выделить?
Помимо ядра и облака электронов, особенности строения атомов металла включают наличие внутренних энергетических уровней электронов, разделенных на энергетические оболочки. Металлы также имеют свободные электроны в своей последней оболочке, которые отвечают за электрическую проводимость и могут перемещаться между атомами металла.
Каково значение особенностей строения атомов металла для понимания свойств металлов?
Понимание особенностей строения атомов металла помогает объяснить такие свойства металлов, как проводимость электричества и тепла, высокая пластичность и формоизменяемость, блеск и т. д. Перемещение свободных электронов между атомами металла позволяет металлам проводить электричество и тепло, а их структура дает им прочность и пластичность.
