Атомы металла представляют собой особую форму материи, которая характеризуется уникальными свойствами и структурой. Строение атомов металла играет важную роль в определении их физических и химических свойств.
Одной из особенностей атомов металла является наличие общего электронного облака, которое окружает положительно заряженное ядро. Это облако состоит из внешних электронов, которые не принадлежат ни одному конкретному атому, а перемещаются свободно по всей структуре металла.
Такая структура атомов металла обуславливает их способность проводить электрический ток и тепло. Поэтому металлы имеют высокую электропроводность и теплопроводность по сравнению с другими материалами. Кроме того, наличие общего электронного облака дает металлам определенную пластичность и способность изменять свою форму без разрушения.
Структура атомов металла также влияет на их химические свойства. Взаимодействие атомов регулируется электронной структурой, а именно расположением и количеством внешних электронов. Наличие свободно перемещающихся электронов позволяет металлам образовывать и стабилизировать химические связи с другими атомами, что способствует их химической активности и реакционной способности.
Основные характеристики атомов металла

1. Атомный радиус:
Атомы металла обладают большими атомными радиусами, что связано с их способностью отдавать электроны и образовывать катионы при образовании межатомных связей. Большой атомный радиус обеспечивает высокую подвижность электронов в металле, что является основой его электропроводности.
2. Орбитальная структура:
Атомы металла имеют характерную орбитальную структуру, в которой большую роль играют s- и p-орбитали. S-орбитали заполняются внутренними электронами, а p-орбитали - внешними электронами. Это позволяет металлам образовывать различные типы связей и обладать высокой химической активностью.
3. Металлическая связь:
В металлах осуществляется так называемая металлическая связь, при которой положительно заряженные ядра атомов окружены общим электронным облаком. Это обеспечивает высокую пластичность, проводимость и теплопроводность металлов. Подвижность электронов в металле также обусловливает его способность отдавать электроны и образовывать ионы в реакциях с другими веществами.
4. Кристаллическая структура:
Атомы металла образуют кристаллическую структуру, в которой атомы регулярно упакованы в пространстве. Это обуславливает такие свойства металлов, как механическая прочность и точечная симметрия. Кристаллическая структура также влияет на процессы деформации и рекристаллизации металлов.
5. Атомные массы:
Атомы металла характеризуются большими атомными массами. Это связано с наличием в их ядрах большого числа протонов и нейтронов. Большие атомные массы обусловливают высокую плотность и прочность металлов.
6. Внутренняя энергия:
В атомах металла содержится значительная внутренняя энергия, которая определяет их термические свойства. Металлы хорошо проводят тепло, так как энергия быстро передается между их атомами.
Внутренняя структура атомов металла
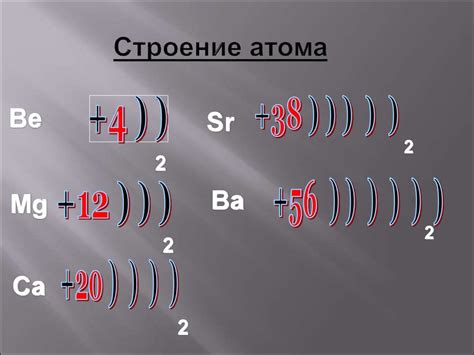
Атомы металла имеют особенную внутреннюю структуру, которая обусловлена их электронной оболочкой. Каждый атом металла состоит из ядра и электронов, которые образуют оболочки вокруг ядра.
Ядро атома металла содержит протоны, которые являются положительно заряженными частицами, и нейтроны, которые не имеют заряда. Протоны и нейтроны находятся в ядре вместе и определяют массу атома.
Вокруг ядра находятся электроны, которые являются отрицательно заряженными частицами. Электроны располагаются на разных энергетических уровнях, называемых оболочками. Количество электронов в каждой оболочке определяется по формуле 2n^2, где n - номер оболочки. Первая оболочка может содержать только 2 электрона, вторая - 8 электронов, третья - 18 и т.д.
Внутренняя структура атомов металла позволяет им образовывать кристаллическую решетку, благодаря которой металлы имеют свои характерные физические и химические свойства. Кристаллическая решетка образуется в результате упорядоченного расположения атомов и связей между ними.
Структура атомов металла также играет важную роль в их проводимости электричества и тепла. Благодаря наличию свободных электронов, металлы могут проводить электрический ток и передавать тепло. Это свойство делает металлы одними из наиболее востребованных материалов в различных областях науки и техники.
Электронная оболочка атомов металла

Электронная оболочка атома металла состоит из электронов, которые посредством своих движений создают большую часть специфических свойств металлов. Общее число электронов в атоме определяется по атомному номеру элемента и может варьироваться от одного до нескольких сотен.
Электроны, находящиеся на наиболее удаленных от ядра энергетических уровнях, образуют внешнюю электронную оболочку. Именно эти электроны играют ключевую роль в химических реакциях и взаимодействии атомов металла с другими элементами.
В электронной оболочке атома металла электроны распределены по областям, называемым орбиталями. Каждый орбиталь способен вместить определенное количество электронов. Первый энергетический уровень может содержать до 2 электронов, второй - до 8, третий - до 18 и так далее.
Наиболее значимыми являются внешние оболочки, так как именно электроны, находящиеся в этих оболочках, обозначают химические свойства металлов. Вплоть до пяти внешних электронов, атомы металлов обладают высокой химической активностью, что обусловлено их стремлением завершить электронную оболочку путем отдачи лишних электронов в реакциях.
Связь атомов металла в кристаллической решетке
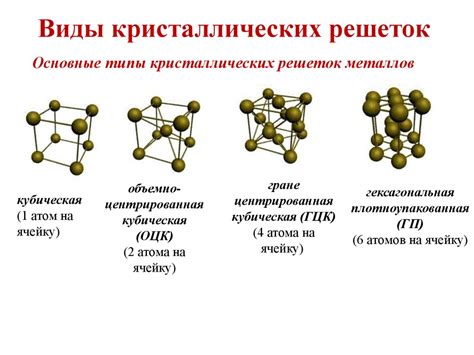
Металлы характеризуются наличием упорядоченной кристаллической решетки, в которой атомы занимают определенные позиции. Связь между атомами в металлах обычно является металлической связью, которая происходит за счет обмена электронами.
В кристаллической решетке металла каждый атом окружен несколькими соседними атомами. Эти атомы составляют так называемую "электронную оболочку", которая образуется за счет электронов валентной оболочки атома. Электроны валентной оболочки образуют так называемое "море электронов", которое свободно движется по всей кристаллической решетке и обеспечивает металлическую проводимость.
Металлическая связь обеспечивает основные свойства металлов, такие как теплопроводность, электропроводность, пластичность и тугоплавкость. Свободное движение электронов в металлической решетке позволяет электрическим сигналам быстро распространяться по материалу и обеспечивает проводимость тепла.
Кристаллическая решетка металлов может быть различных типов, в зависимости от их химического состава и собственной структуры. В некоторых случаях атомы металла могут формировать сложные трехмерные структуры, такие как кубическая гранецентрированная (гцк) или кубическая гексагональная (гкр) решетки, а в других случаях – плоские слои, как, например, в металлах с плотноупакованной решеткой.
Вопрос-ответ

Каковы основные особенности строения атомов металла?
Основные особенности строения атомов металла заключаются в наличии внешних электронных оболочек, которые могут эффективно взаимодействовать с другими атомами, и наличии внутреннего ядра, которое содержит протоны и нейтроны.
Какова структура атомов металла?
Структура атомов металла состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, внешние электроны которой могут участвовать в химических реакциях.
