Атомы металлов 1 группы периодической системы располагаются в первом периоде и имеют общую внешнюю электронную конфигурацию s1. К данным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Все они химически активны, так как стремятся освободить свой внешний электрон и образовать положительный ион.
Атом металла 1 группы состоит из ядра, окруженного электронными облаками. Ядро состоит из протонов и нейтронов, которые обеспечивают положительный заряд атома. Протоны и нейтроны находятся в ядре, а электроны расположены в облаках, называемых электронными оболочками.
Особенностью атомов металлов 1 группы является наличие одного внешнего электрона в s-оболочке, который легко отдаётся при химических реакциях. Это свойство делает атомы металлов 1 группы химически активными и способными образовывать ионы с положительным зарядом.
Интересно отметить, что атомы лития, натрия, калия, рубидия и цезия имеют разные размеры, при этом размер атома увеличивается по мере движения по группе сверху вниз. Это обусловлено увеличением числа электронных оболочек и увеличением радиуса атома.
Свойства атомов металлов 1 группы определяют положение их в периодической системе и химические свойства. Например, они обладают высокими электропроводностями и теплопроводностями, а также способностью реагировать с кислородом и водой.
Строение атома металла 1 группы

Атомы металлов 1 группы периодической системы находятся в первом периоде и имеют общую характеристику - наличие одного электрона в внешней оболочке.
В атоме металла 1 группы на самом внешнем энергетическом уровне находится один электрон, который легко отдается и образует положительный ион. Это электрон в оболочке s, который характеризуется высокими энергетическими уровнями и большой долей свободных электронов.
Строение атома металла 1 группы позволяет объяснить множество свойств данных металлов. Например, низкую температуру плавления и кипения - обусловленную слабостью связи между атомами.
Также, благодаря свойствам одного электрона в внешней оболочке, металлы 1 группы отличаются хорошей электропроводностью и теплопроводностью. Электроны легко передаются от одного атома к другому, что обуславливает их металлические свойства.
В целом, строение атома металла 1 группы играет важную роль в определении свойств этих металлов, таких как электропроводность, теплопроводность, металлический блеск и др.
Символическое обозначение и порядковый номер в таблице Менделеева
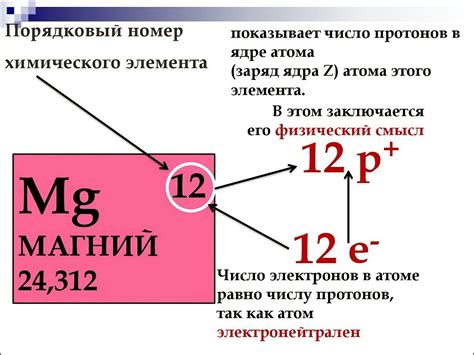
Атом металла 1 группы , располагающийся в первом столбце периодической системы Д.И.Менделеева, имеет символическое обозначение. Оно состоит из одной или двух букв. Буквы, составляющие символ, могут быть как заглавными, так и строчными.
Например, символическое обозначение атома натрия является буквой "Na", что соответствует его латинскому названию "Natrium". В таблице Менделеева атом натрия имеет порядковый номер 11.
Важно отметить, что символическое обозначение и порядковый номер атомов металлов 1 группы могут быть использованы для определения рода элемента и его химических свойств. Эти свойства включают высокую электропроводность, глянцевый блеск, низкую электроотрицательность и образование положительных ионов при химических реакциях.
Поэтому, зная символическое обозначение и порядковый номер атома металла 1 группы, возможно определить его основные свойства и узнать о его участии в различных химических реакциях и соединениях.
Количество электронов на внешней энергетической поверхности
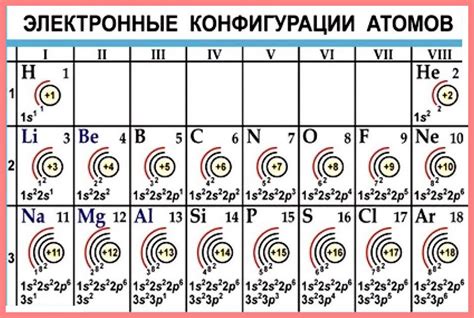
Атомы металлов 1 группы расположены в первом периоде периодической системы и имеют превалирующее количество электронов на внешней энергетической поверхности. Каждый атом металла 1 группы содержит один электрон в валентной оболочке.
Этот электрон находится на s-орбитали и легко вступает в химические реакции. Во внешней энергетической поверхности атома металла 1 группы находится одно электронное облако, способное легко переходить из одной частицы в другую. Это обеспечивает особые свойства металлов 1 группы - хорошую электропроводность, магнитные свойства и способность образовывать ионы положительного заряда.
Такая особенность строения атома металла 1 группы имеет важное значение для их использования в различных областях, включая электротехнику, строительство и химическую промышленность. Также она определяет их место в периодической системе и позволяет проводить химические реакции для синтеза новых соединений и материалов.
Особенности электронной конфигурации атома металла 1 группы

Атом металла 1 группы имеет особенную электронную конфигурацию, обусловленную его положением в периодической системе элементов. Все атомы металлов 1 группы имеют одну валентную электронную оболочку, которая состоит из одного электрона на последней энергетической уровне.
Этот электрон валентной оболочки отвечает за химические свойства атома металла. Валентный электрон легко может быть отдан или принят другими атомами, что обусловливает высокую реактивность металлов 1 группы. Благодаря наличию только одного электрона на внешнем энергетическом уровне, атомы металлов 1 группы стремятся либо потерять этот электрон и образовать положительный ион, либо принять один или два электрона и образовать отрицательные ионы.
Так как все атомы металлов 1 группы имеют одинаковую электронную конфигурацию валентной оболочки, их химические свойства схожи. Все эти металлы обладают отличными проводящими свойствами и низкой электроотрицательностью, что делает их хорошими металлическими проводниками для электричества и тепла.
Электронная конфигурация атомов металлов 1 группы определяет их очень высокую реактивность. Реакции с участием этих металлов обычно сопровождаются выделением большого количества тепла и образованием ионов с положительным зарядом. Это свойство делает металлы этой группы нестабильными и склонными к реакциям с другими веществами.
Влияние внешней электронной конфигурации на химические свойства

Строение атома металла 1 группы характеризуется наличием одной внешней электронной оболочки, содержащей одну или две электрона. Это делает их особенными среди других элементов. Влияние внешней электронной конфигурации на химические свойства металлов 1 группы проявляется в их активности и способности образовывать ионы положительного заряда.
Атомы металлов 1 группы имеют большую тенденцию отдавать свою внешнюю электронную оболочку, чтобы достичь стабильной конфигурации инертного газа. Это свойство делает их отличными реагентами и способствует их реакционной активности. Металлы 1 группы проявляют сильную электроотрицательность и хорошую ионизационную энергию, что делает их способными образовывать ионы положительного заряда.
Благодаря наличию одной внешней электронной оболочки, металлы 1 группы образуют ионы с однозначным зарядом, что обеспечивает простоту в реакциях их соединений. Это позволяет металлам 1 группы активно участвовать в различных химических реакциях, образуя стабильные и реактивные соединения.
Внешняя электронная конфигурация металлов 1 группы также определяет их химические свойства. Металлы с одним электроном во внешней оболочке, например литий, натрий и калий, образуют наиболее летучие и воспламеняющиеся соединения с водой и кислородом. Металлы с двумя электронами во внешней оболочке, например магний, стронций и барий, образуют менее реактивные соединения, но все равно могут образовывать стабильные и реактивные соединения в различных реакциях.
Физические свойства атома металла 1 группы

Атом металла из 1 группы периодической системы имеет своеобразные физические свойства. Одной из особенностей таких атомов является наличие одного электрона в внешней электронной оболочке. Это делает их очень реактивными элементами, способными активно взаимодействовать с другими веществами.
Электрон в внешней оболочке атома металла 1 группы находится на s-орбитали, что делает его относительно легко отделимым от атома. Именно этот электрон обеспечивает высокую металлическую проводимость и термическую проводимость вещества, а также способность к деформации и формированию металлической структуры.
Атомы металлов 1 группы обладают малым энергетическим зазором между валентной и внутренними энергетическими уровнями. Это позволяет им заглушать световые волны в видимой области спектра и придавать им металлический блеск. Также из-за низкого энергетического зазора атомы металлов способны поглощать и испускать энергию в виде тепла, что обусловливает их высокую теплопроводность.
Одной из самых известных физических свойств атома металла 1 группы является его способность образовывать ионы положительного заряда при потере внешнего электрона. Это свойство позволяет металлам образовывать соли и обуславливает их реактивность при взаимодействии с другими элементами.
Химические свойства атома металла 1 группы

Атомы металлов первой группы характеризуются высокой активностью и способностью образовывать ионные соединения. Это связано с тем, что у них внешний энергетический уровень содержит один электрон, который легко отдаётся при взаимодействии с другими элементами.
Металлы первой группы, такие как литий (Li), натрий (Na) и калий (K), реагируют со многими неметаллами, например, с кислородом, хлором и серой, образуя соответствующие оксиды, хлориды и сульфиды. Однако, вода является самым активным реагентом для этих металлов. При контакте с водой они реагируют с выделением водорода и образованием гидроксидов металлов.
Металлы первой группы могут быть использованы для производства различных химических соединений. Например, оксид лития (Li2O) используется в батареях и керамике, а хлорид натрия (NaCl) – в процессе пищеварения и медицине. Кроме того, металлы первой группы широко применяются в промышленности для получения различных металлических сплавов и легирования других металлов.
Важность атомов металла 1 группы в промышленности и научных исследованиях

Атомы металла 1 группы играют важную роль в промышленности и научных исследованиях благодаря своим уникальным свойствам и структуре.
Первая группа металлов включает в себя калий, натрий, литий и другие элементы, которые отличаются высокой реактивностью и способностью образовывать ионы положительного заряда. Именно благодаря этим свойствам атомы металла 1 группы широко применяются в промышленных процессах.
Одним из примеров использования атомов металла 1 группы является производство синтетических удобрений. Калийные соединения, полученные из калия, являются необходимыми компонентами для повышения плодородности почвы. Эти соединения обеспечивают растения необходимыми питательными элементами, такими как калий, что позволяет достичь более высоких урожаев.
Также атомы металла 1 группы широко используются в процессе производства стекла. Литий, например, добавляется в состав стекла, чтобы улучшить его оптические свойства и снизить температуру плавления. Это позволяет производить более качественное стекло с меньшими энергозатратами.
В научных исследованиях атомы металла 1 группы используются для разработки новых материалов и технологий. Например, натрий применяется в процессе создания солнечных батарей, а калий - в разработке лекарственных препаратов. Это связано с уникальными свойствами данных элементов, позволяющими применять их в различных отраслях науки и промышленности.
Таким образом, атомы металла 1 группы не только имеют большое значение в промышленности, но и являются предметом научных исследований, открывая новые возможности для создания инновационных материалов и технологий. Их уникальные свойства и способность образовывать положительно заряженные ионы делают их очень важными компонентами для реализации различных промышленных и научных проектов.
Вопрос-ответ

Каково строение атома металла 1 группы?
Строение атома металла 1 группы представляет собой ядро, состоящее из протонов и нейтронов, вокруг которого движутся электроны по определенным энергетическим уровням или оболочкам.
Какие электроны могут находиться на внешней энергетической оболочке атома металла 1 группы?
На внешней энергетической оболочке атома металла 1 группы находится только один электрон.
Какие свойства обладает атом металла 1 группы из-за наличия одного электрона на внешней энергетической оболочке?
Атом металла 1 группы из-за наличия одного электрона на внешней энергетической оболочке обладает высокой химической активностью и легко образует соединения с другими элементами.
Почему атом металла 1 группы обладает высокой химической активностью?
Атом металла 1 группы обладает высокой химической активностью из-за наличия одного электрона на внешней энергетической оболочке. Этот электрон легко может быть передан другим элементам, что позволяет атому металла образовывать соединения и участвовать в химических реакциях.
