Металлы главных подгрупп химической системы Д.И.Менделеева представляют собой ряд химических элементов, которые обладают рядом уникальных особенностей. Они располагаются в первых и вторых подгруппах и включают элементы с атомными номерами от 3 до 12.
Один из наиболее интересных аспектов металлов главных подгрупп - их химическая активность. На протяжении веков эти элементы использовались в различных отраслях промышленности и научных исследованиях благодаря своей способности вступать в химические реакции и образовывать стабильные соединения с другими элементами.
Особености металлов главных подгрупп также связаны с их физическими свойствами, такими как высокая электропроводность, теплопроводность, пластичность и прочность. Эти свойства делают эти металлы незаменимыми материалами для создания различных изделий, от проводов и металлических конструкций до современных электронных устройств и автомобилей.
Важно отметить, что каждый металл главных подгрупп имеет свои уникальные особенности и применение. Например, литий наиболее легкий металл главных подгрупп, характеризующийся высокой химической реакции с кислородом. Алюминий же, наоборот, пассивный металл с высокой стойкостью к окислению.
Важно подчеркнуть, что металлы главных подгрупп являются одним из основных строительных блоков промышленности и современной технологии. Их уникальные свойства и возможности стали основой для создания широкого спектра материалов и изделий, которые используются в различных сферах нашей жизни.
Химические свойства металлов главных подгрупп

Металлы главных подгрупп, будь то щелочные, щелочноземельные или элементы главных подгрупп переходных металлов, обладают характерными химическими свойствами. Они активно участвуют в различных реакциях и образуют соединения с другими элементами.
Во-первых, металлы главных подгрупп обладают высокой реакционной способностью. Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), реагируют с водой, высвобождая водород и образуя гидроксиды. Щелочноземельные металлы, такие как магний (Mg), кальций (Ca) и барий (Ba), образуют гидроксиды и газообразный водород при реакции с водой.
Во-вторых, металлы главных подгрупп образуют стабильные соли с кислотами. Например, щелочные металлы образуют соли с сульфатами, нитратами, хлоридами и другими кислотами. Щелочноземельные металлы также образуют соли, но их реакционная способность ниже, чем у щелочных металлов.
Кроме того, металлы главных подгрупп могут образовывать специфические соединения. Переходные металлы, например, способны образовывать комплексные соединения, в которых металл координируется с атомами или молекулами других веществ. Эти соединения могут иметь различные цвета и обладать уникальными физическими свойствами.
Таким образом, химические свойства металлов главных подгрупп определяют их роль в реакциях, их способность образовывать соединения с другими элементами и их химическую активность. Изучение этих свойств играет важную роль в химии и позволяет понять особенности строения и взаимодействия металлов в различных средах.
Окислительная способность и реакции с кислотами
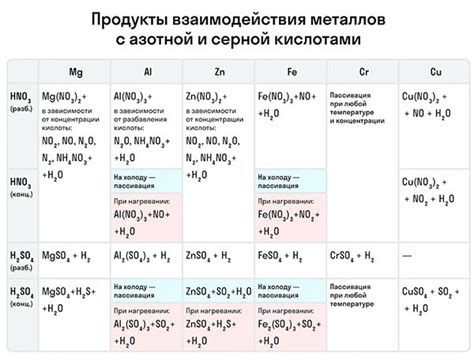
Окислительная способность – одна из важных характеристик металлов главных подгрупп, определяющая их реакционную активность. Металлы различных главных подгрупп имеют разные окислительные свойства. Например, металлы первой подгруппы (щелочные металлы) обладают сильной окислительной способностью, способностью вступать в реакции с водой с образованием щелочей и выделением водорода.
Реакция щелочных металлов с кислотами обычно протекает с выделением водорода и образованием солей. Например, натрий реагирует с соляной кислотой:
- 2Na + 2HCl → 2NaCl + H2
Более реактивные щелочные металлы, такие как литий и калий, реагируют даже с более слабыми кислотами, такими как уксусная кислота:
- 2Li + 2CH3COOH → 2LiCH3COO + H2
- 2K + 2CH3COOH → 2KCH3COO + H2
Металлы второй подгруппы (щелочноземельные металлы) также могут реагировать с кислотами, но их реакционная активность уже не так высока, как у металлов первой подгруппы.
Металлы главной подгруппы (не щелочные и не щелочноземельные) обладают гораздо меньшей окислительной способностью и реакционной активностью по сравнению с металлами главных подгрупп. Они не реагируют с кислотами при обычных условиях.
Способность к образованию катионов разных степеней окисления
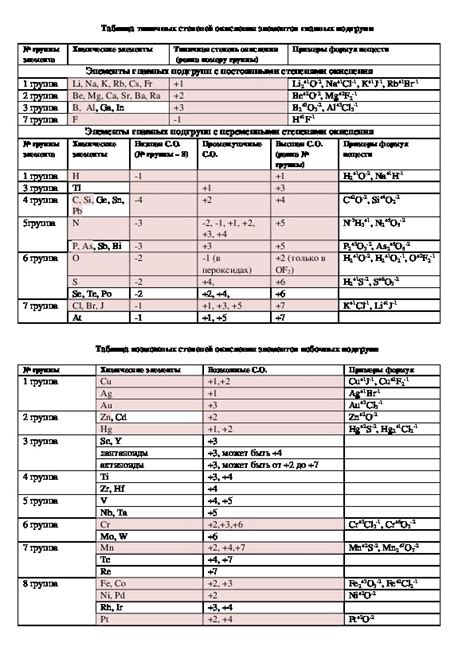
Металлы главных подгрупп периодической системы обладают способностью образовывать катионы разных степеней окисления. Катион - это положительно заряженная частица, образующаяся при потере одного или нескольких электронов металлом.
Основной фактор, влияющий на способность металлов к образованию катионов разных степеней окисления, это энергия ионизации. Чем ниже энергия ионизации металла, тем легче ему отдавать электроны и образовывать катионы более высокой валентности.
Степень окисления металла указывает на количество электронов, которые он отдал при образовании катиона. Например, железо может образовывать катионы Fe2+ и Fe3+, указывая на то, что оно отдало 2 или 3 электрона соответственно.
Способность к образованию катионов разных степеней окисления имеет важное значение как для химических свойств металлов, так и для их использования в различных процессах и промышленности. Например, металлы с различными степенями окисления могут образовывать разнообразные соединения и сочетания, что позволяет использовать их в качестве катализаторов, реагентов и материалов для различных видов конструкций.
Вопрос-ответ

Какие элементы входят в главные подгруппы металлов?
В главные подгруппы металлов входят такие элементы, как алкалий, щелочноземельные металлы, а также металлы главной подгруппы периодической системы – цинк, кадмий и ртуть.
Какие особенности имеют металлы главной подгруппы периодической системы?
Металлы главной подгруппы периодической системы обладают низкой плотностью и низкой плавкостью. Они также обладают высокой химической активностью и могут реагировать с кислородом, азотом и другими элементами.
Какие свойства характерны для алкалий?
Алкалии являются металлами главной подгруппы периодической системы. Они обладают низкой плотностью и низкой плавкостью. Алкалии очень активны химически и реагируют с водой, взрываясь.
Какие свойства отличают щелочноземельные металлы?
Щелочноземельные металлы также являются металлами главной подгруппы периодической системы. Они обладают высокой плотностью и плавкостью. Щелочноземельные металлы реагируют с водой, но не так активно, как алкалии.
