Электронное строение атомов металла является одним из ключевых факторов, определяющих их особенности и свойства. Атомы металлов имеют уникальное строение электронной оболочки, которое определяет их способность к проводимости тепла и электричества, высокую пластичность, прочность и другие свойства.
Одной из особенностей электронного строения атомов металла является их наличие свободных электронов внешней оболочки. В отличие от атомов неметаллов, у которых внешняя оболочка обычно заполнена электронами, атомы металлов имеют неполностью заполненную внешнюю оболочку, что позволяет им легко участвовать в химических реакциях и образовывать ионы. Именно свободные электроны в атомах металлов обеспечивают проводимость электричества и тепла.
Кроме того, электронное строение атомов металла определяет их малый размер и высокую плотность. Атомы металлов обычно имеют малый радиус, что делает их компактными и обеспечивает высокую плотность. Благодаря этому металлы обладают высокой прочностью и устойчивостью к механическим воздействиям.
В целом, электронное строение атомов металлов является основой для понимания их особенностей и свойств. Свободные электроны внешней оболочки обеспечивают высокую электрическую и термическую проводимость, а малый размер и высокая плотность атомов металла способствуют их прочности и устойчивости. Понимание особенностей электронного строения атомов металла имеет важное значение для развития и применения металлургической и электронной индустрии.
Особенности электронного строения атомов металла
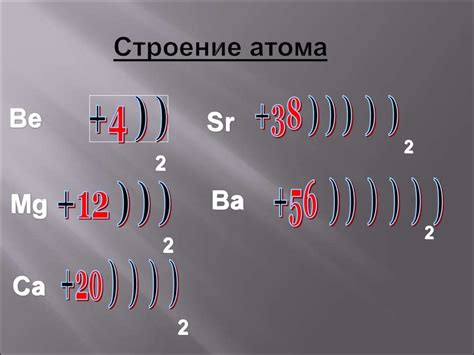
1. Внешняя оболочка электронов. Атомы металлов имеют характерную особенность в виде наличия небольшого количества электронов на своей внешней оболочке. Это делает металлы хорошими проводниками электричества и тепла.
2. Валентные электроны. Валентными электронами называются электроны на внешней оболочке атома, которые принимают участие в химических реакциях. Атомы металлов имеют малое количество валентных электронов, обычно один или несколько. Это позволяет им образовывать металлические связи и обладать способностью к образованию кристаллической решетки.
3. Металлическая связь. Металлы обладают особой формой связи между атомами, называемой металлической связью. Она основана на перемещении свободных электронов в металлической решетке. Такая связь обеспечивает прочность металла, его электропроводность и теплопроводность.
4. Ионизационная энергия. Атомы металлов имеют малую ионизационную энергию, то есть энергию, необходимую для удаления электрона с атома. Это объясняет их способность отдавать электроны и образовывать положительные ионы.
5. Катионы. При потере одного или нескольких электронов металлы образуют положительно заряженные катионы. Катионы металлов обладают меньшим радиусом по сравнению с нейтральными атомами и имеют более высокую электропроводность.
В результате этих особенностей электронного строения атомов металлов образуют кристаллическую решетку с высокой скоростью электронов, что придает металлам такие свойства, как высокая теплопроводность, электропроводность, пластичность и хорошая прочность.
Определение понятия и основные характеристики

Электронное строение атомов металла определяет их основные характеристики и свойства. Атомы металла состоят из электронов, протонов и нейтронов, и их электронная оболочка играет важную роль в определении их химических и физических свойств.
Электронная оболочка атома металла состоит из энергетических уровней, на которых могут находиться электроны. Каждый уровень может вместить определенное количество электронов, которое определяется по правилу заполнения уровней. Первый энергетический уровень, ближайший к ядру, может вместить до 2 электронов, второй уровень - до 8 электронов, и так далее.
Внешний энергетический уровень, который находится на большем расстоянии от ядра, называется валентным уровнем. На валентном уровне находятся валентные электроны, которые определяют химические свойства атомов металла. Количество валентных электронов для атомов металла может быть разным и определяется их положением в периодической системе элементов.
Валентные электроны обладают высокой подвижностью и легко участвуют в химических реакциях, что делает металлы отличными проводниками электричества и тепла. Электроны на валентном уровне также определяют способность атома металла образовывать ионы - атомы с различным количеством электронов. Эти свойства атомов металла делают их основными строительными блоками металлических материалов и сплавов, которые находят широкое применение в различных отраслях промышленности.
Процесс образования электронной оболочки у атомов металла
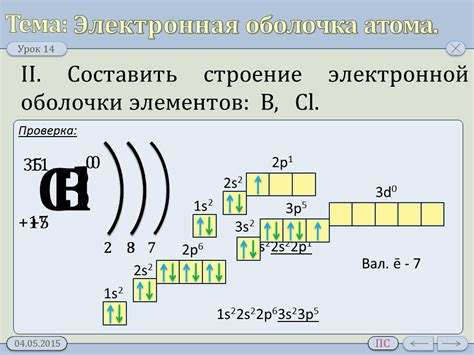
Электронная оболочка атомов металла является основным фактором, определяющим химические и физические свойства металлических элементов. Оболочка состоит из различных энергетических уровней, на которых располагаются электроны.
Процесс образования электронной оболочки у атомов металла происходит на основе заполнения энергетических уровней электронами. Первый энергетический уровень может вместить только два электрона, второй - до восьми, а третий - до восемнадцати.
При заполнении энергетических уровней электронами, атомы металла стремятся к достижению наиболее устойчивого электронного конфигурационного состояния - состояния с полностью заполненными s- и p-подуровнями.
Таким образом, электронная оболочка у атомов металла формируется путем постепенного заполнения энергетических уровней в соответствии с принципом Паули и правилом Гунда.
Образование полностью заполненных электронных оболочек придает атомам металла стабильность и электроотрицательность, что влияет на их свойства, такие как электропроводность, теплопроводность, пластичность и металлический блеск.
Свойства электронной оболочки металлических атомов
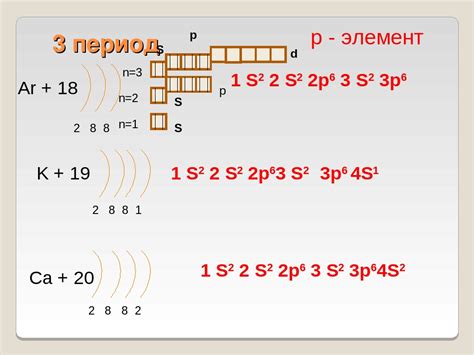
1. Проводимость электричества: Одним из основных свойств металлов является их высокая проводимость электричества. Это объясняется наличием свободных электронов в электронной оболочке металлических атомов. Эти электроны могут свободно перемещаться по металлической решетке, что позволяет металлам эффективно проводить электрический ток.
2. Проводимость тепла: Металлы также обладают высокой проводимостью тепла. Это связано с тем, что свободные электроны в электронной оболочке могут передавать энергию от одного атома к другому путем колебаний и соприкосновений, что обеспечивает эффективную передачу тепла внутри металлического материала.
3. Пластичность и деформируемость: Металлы обладают пластичностью и деформируемостью, то есть они легко поддаются изменению формы и могут быть вытянуты в тонкие проволоки или сплющены в плоские листы. Это связано с наличием слабых межатомных связей и возможностью перемещения электронов внутри металлической решетки.
4. Блеск и отражательность: Металлы обладают блеском и хорошей отражательностью света. Это происходит из-за того, что свободные электроны в металлических атомах могут поглощать и переизлучать световые волны, создавая эффект блика и отражения.
5. Магнитные свойства: Некоторые металлы обладают магнитными свойствами. Это связано с особым расположением электронов в электронной оболочке и их спиновым моментом. Магнитные металлы притягиваются к магнитному полю и способны создавать собственные магнитные поля.
6. Формирование ионов: В некоторых условиях, металлические атомы могут потерять свои свободные электроны и образовать положительно заряженные ионы. Это связано с возможностью отделения электронов от металлической решетки и образования ионов с недостающими электронами.
Взаимодействие электронной оболочки атомов металла с окружающей средой

Электронная оболочка атомов металла играет ключевую роль в их взаимодействии с окружающей средой. У металлов особенности электронного строения, которые придают им уникальные свойства.
В электронной оболочке металлических атомов находится большое количество свободных электронов. Это связано с особенностями внутреннего строения атома металла. Свободные электроны способны легко перемещаться по всей оболочке, образуя так называемую электронную облако.
Такие свободные электроны являются основой для многих характерных свойств металлов. Они способны гибко взаимодействовать с электрическими и магнитными полями, а также с другими частицами окружающей среды. Это позволяет металлам быть отличными проводниками электричества и тепла, а также обладать высокой пластичностью и хорошей деформируемостью.
Взаимодействие электронной оболочки атомов металла с окружающей средой также определяет их химическую активность. Металлы обладают способностью вступать в реакции с другими веществами, образуя различные соединения. Это связано с возможностью обмена свободными электронами металла с электронами других атомов.
Таким образом, электронная оболочка атомов металла играет решающую роль в их взаимодействии с окружающей средой. Она обуславливает уникальные свойства металлов и их способность быть хорошими проводниками, гибкими и активными в химических реакциях.
Вопрос-ответ

Какие особенности электронного строения атомов металла влияют на их свойства?
Особенности электронного строения атомов металла, такие как наличие свободных электронов в проводимой зоне и дискретных энергетических уровней, влияют на их свойства. Наличие свободных электронов позволяет металлам проводить электрический ток и обладать высокой электропроводностью. Дискретные энергетические уровни металлов обеспечивают образование характерных спектров поглощения и испускания света.
Чем отличается электронное строение атомов металла от электронного строения атомов неметалла?
Основное отличие между электронным строением атомов металла и неметалла заключается в наличии или отсутствии свободных электронов в проводимой зоне. Атомы металла имеют свободные электроны в проводимой зоне, что обуславливает их высокую электропроводность. В то же время, атомы неметалла не имеют таких свободных электронов и обладают характеристиками, отличными от металлов.
Что такое проводимая зона в электронной структуре атомов металла?
Проводимая зона в электронной структуре атомов металла - это энергетическая зона, в которой находятся свободные электроны, способные передвигаться по материалу и образовывать электрический ток. Проводимая зона является результатом перекрытия энергетических уровней между атомами металла.
Какие свойства обусловлены электронным строением атомов металла?
Электронное строение атомов металла обуславливает ряд свойств, таких как высокая теплопроводность и электропроводность металлов, способность металлов образовывать специфическую кристаллическую решетку и влиять на их объем, магнитные свойства металлов и другие. Наличие свободных электронов позволяет электронам передвигаться свободно, что способствует электропроводности и теплопроводности металлов.
