Щелочные металлы представляют собой группу элементов, которые находятся в первой группе периодической системы. Эта группа включает литий, натрий, калий, рубидий, цезий и франций. Отличительной особенностью этих элементов является их высокая реактивность, что связано с особенностями их электронного строения.
Атомы щелочных металлов содержат один валентный электрон, находящийся на самом последнем энергетическом уровне. Этот электрон легко отделяется от атома, образуя положительный ион, так как энергетический уровень с одним электроном стабилен и стремится заполнить его до восьми электронов, соответствующих полностью заполненному внутреннему энергетическому уровню.
Благодаря этому особому электронному строению, щелочные металлы проявляют высокую активность в реакциях с различными веществами. Они могут легко образовывать соединения с другими элементами, особенно с галогенами, образуя ионные соединения, а также образовывать сплавы с другими металлами.
Структура атомов щелочных металлов

Атомы щелочных металлов, таких как литий, натрий, калий и другие, имеют особенную электронную структуру, что делает их уникальными и важными в различных химических реакциях и применениях.
Основной особенностью электронного строения атома щелочных металлов является наличие одного электрона в внешней оболочке. Этот электрон называется валентным электроном и обладает высокой энергией, что делает щелочные металлы очень реактивными.
Валентный электрон находится на последнем энергетическом уровне, который называется s-подуровнем. Этот подуровень имеет форму сферы и может содержать до двух электронов. Таким образом, атомы щелочных металлов имеют одно или два электрона на внешнем энергетическом уровне.
Из-за наличия только одного валентного электрона, щелочные металлы имеют склонность к тому, чтобы отдать его другим элементам, образуя ионы положительного заряда. Такие ионы называются катионами и обладают большой химической активностью.
Благодаря своей электронной структуре и реактивности, щелочные металлы находят широкое применение в различных областях, включая металлургию, производство батарей, фармацевтическую промышленность и др.
Основные черты строения
Атомы щелочных металлов имеют особое электронное строение, которое обусловлено особенностями их электронной оболочки.
У данного класса элементов на внешней электронной оболочке всего один электрон. Он находится в s-орбитали, обозначаемой как ns1. Все эти элементы обладают похожими химическими свойствами, так как у них одно электронное айонное ядро.
Из-за наличия одного электрона во внешней оболочке, атомы щелочных металлов легко отдают его, образуя положительно заряженный ион. При этом уровень энергии ионов соответствует энергии, необходимой для удаления одного электрона с атома щелочного металла.
Электронный строй одноэлектронных положительных ионов щелочных металлов также характеризуется наличием всего одного электрона на внешней оболочке, но уже без валентных электронов. Это является основной причиной высокой химической активности ионов щелочных металлов, так как их электронная оболочка хорошо подходит для приема дополнительных электронов.
Энергетические уровни и электронная оболочка
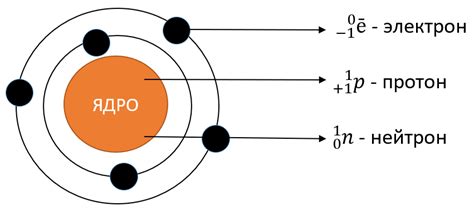
Электронная оболочка атома щелочного металла состоит из нескольких энергетических уровней, на которых располагаются электроны. Каждый уровень имеет свое энергетическое значение, которое определяет силу, с которой электроны притягиваются к ядру атома.
На каждом энергетическом уровне может находиться определенное количество электронов. Согласно правилу восеми, первый энергетический уровень может содержать не более 2 электронов, второй - 8 электронов, третий - 18 электронов. Всего щелочные металлы имеют одну электронную оболочку, которая состоит из s-орбитали.
С учетом электронной конфигурации, щелочные металлы имеют химические свойства, связанные с высокой реактивностью. Это обусловлено тем, что электроны в с-орбитали находятся на достаточно большом расстоянии от ядра, поэтому они легко участвуют в химических реакциях и образуют соединения с другими элементами.
Электронное облако и заряд ядра
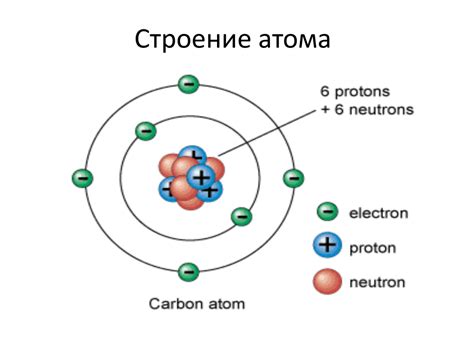
Электронное облако - это область пространства вокруг атомного ядра, где находятся электроны. Оно представляет собой некоторую вероятность обнаружить электрон в определенной точке. Размер и форма электронного облака зависят от энергетического состояния электронов в атоме.
Заряд ядра - это сумма положительных зарядов протонов, которые находятся в атомном ядре. Щелочные металлы имеют один электрон в своем внешнем энергетическом уровне, что делает их химически активными. Заряд ядра этих металлов определяет их электронную конфигурацию и свойства.
В атомах щелочных металлов электронное облако имеет сложную структуру, которая обусловлена наличием нескольких энергетических уровней и подуровней. Наиболее вероятная область обнаружения электронов называется электронной оболочкой и может быть представлена в виде электронной конфигурации.
Заряд ядра определяет силу электрического поля, создаваемого атомом, обусловливающего электронные связи между атомами и взаимодействие с внешними электрическими полями. Влияние заряда ядра на электронное облако может быть описано с помощью квантовой механики, которая рассматривает вероятностные распределения электронов вокруг ядра.
Строение атома натрия
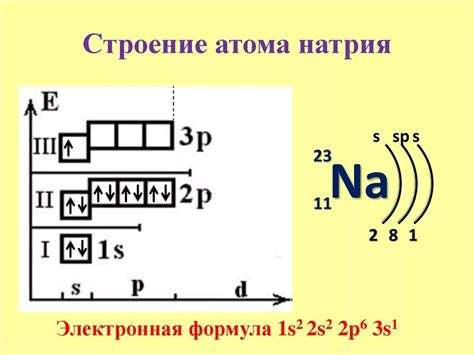
Атом натрия имеет электронную оболочку, состоящую из трех уровней энергии: K, L и M. Ближайшая к ядру оболочка - K-оболочка, на которой расположено 2 электрона. Второй уровень энергии - L-оболочка, может вместить максимум 8 электронов, и на ней, соответственно, находится 8 электронов. Третий уровень энергии - M-оболочка, может вместить до 8 электронов, и на нем находится 1 электрон.
Особенностью электронного строения атома натрия является то, что на последнем (M) уровне расположен один электрон. Такое расположение электрона позволяет атому натрия легко отдавать этот электрон при взаимодействии с другими атомами. В результате этого процесса атом натрия образует положительный ион Na+, ставящийся в соединении с другим атомом или ионом. Такие положительные ионы, активно участвующие в химических реакциях, делают натрий щелочным металлом.
Уникальные свойства металлов щелочной группы
Металлы щелочной группы отличаются рядом уникальных свойств, которые делают их особенно важными в различных областях науки и техники.
Первое уникальное свойство – низкая температура плавления и кипения. Например, литий плавится при температуре всего около 180 градусов Цельсия, а для кипения ртути, наиболее тяжелого из металлов щелочной группы, достаточно всего 356 градусов Цельсия. Такое низкое значение обусловлено низким электростатическим взаимодействием между атомами.
Второе уникальное свойство – большая мягкость и пластичность. Металлы щелочной группы можно легко резать ножом или даже рукой. Это обусловлено слабой связью между атомами и отсутствием электронов в d-оболочке. Благодаря этой свойству, металлы щелочной группы находят широкое применение в производстве батареек, сплавов и других материалов.
Третье уникальное свойство – огромная реактивность. Металлы щелочной группы активно взаимодействуют с водой, кислородом и другими химическими веществами. Они образуют щелочные растворы, которые могут быть использованы для нейтрализации кислот и реагировать с различными соединениями, такими как атомы ионы. Это свойство является основой для широкого применения щелочных металлов в химической промышленности и медицине.
Четвертое уникальное свойство – низкая плотность. Металлы щелочной группы обладают низкой плотностью и легкостью, что делает их идеальными для использования в различных легких конструкциях, таких как авиационная и космическая промышленность. При этом они обладают высокой теплопроводностью и электропроводностью, что делает их замечательными материалами для проводов и теплообменных установок.
Вывод: Металлы щелочной группы обладают уникальными свойствами, которые определяют их важность и широкое применение в различных сферах. Их низкая температура плавления и кипения, мягкость и пластичность, высокая реактивность и низкая плотность делают их ценными материалами для различных технических и химических процессов.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каково электронное строение атомов щелочных металлов?
Атомы щелочных металлов имеют один электрон в внешней электронной оболочке (с энергетическим уровнем n=2) и полностью заполненные внутренние электронные оболочки. Такое электронное строение делает их электронно-положительно заряженными.
Почему атомы щелочных металлов столь реактивны?
Реактивность щелочных металлов обусловлена их электронной конфигурацией. Атомы этих металлов имеют очень нестабильный одиночный электрон в внешней оболочке, который они стремятся отдать, чтобы достичь стабильной конфигурации. Поэтому они легко вступают в химические реакции с другими веществами, особенно с неметаллами, чтобы образовать стабильные ионы.
Какие ионы образуются при реакции щелочных металлов с неметаллами?
Атомы щелочных металлов, отдавая свой одиночный электрон, образуют положительно заряженные ионы, которые имеют электронную конфигурацию внутренней электронной оболочки. Например, натрий (Na) образует ион Na+, а калий (K) образует ион K+.
Чем отличается электронное строение щелочных металлов от электронного строения других металлов?
Электронное строение щелочных металлов отличается тем, что у них только один электрон в внешней электронной оболочке, тогда как у других металлов обычно несколько электронов в этой оболочке. Это делает щелочные металлы более реактивными и ионизирующими.
