Металлы являются одной из основных групп веществ, которые имеют кристаллическую структуру. Особенностью атомов металлов является их способность образовывать кристаллическую решетку с упорядоченным расположением атомов.
Кристаллическая решетка металла характеризуется высокой координацией атомов, то есть каждый атом металла окружен большим числом соседних атомов. Это обуславливает хорошую механическую прочность и пластичность металлов.
Атомы металлов в кристаллической структуре обладают определенными свойствами, такими как высокая электропроводность, теплопроводность и металлический блеск. Эти свойства связаны с особенностями электронной структуры атомов металлов, где внешние электроны могут свободно двигаться по кристаллической решетке, образуя электронное облако около атомов.
Изучение особенностей атомов в кристаллической структуре металлов позволяет лучше понять и объяснить множество свойств и феноменов, связанных с металлами, а также использовать эти знания в различных областях, включая материаловедение, электронику и технологию.
Атомы металлов: основные характеристики

Металлы - это материалы, которые обладают хорошей электропроводностью и теплопроводностью. Они образуют кристаллическую структуру, состоящую из атомов, которые могут быть разных типов и располагаться в определенном порядке.
Основные характеристики атомов металлов в кристаллической структуре включают:
- Атомный радиус: это расстояние от центра атома до его внешней электронной оболочки. Размер атомов металлов обычно относительно большой, что делает их более подвижными и способными образовывать межатомные связи.
- Электронная конфигурация: атомы металлов имеют небольшое количество внешних электронов, что делает их склонными к образованию металлических связей.
- Центральное положение: атомы металлов расположены в центре кристаллической структуры и образуют кристаллическую решетку. Это позволяет им перемещаться относительно легко и обеспечивает хорошую проводимость электричества и тепла.
- Мобильность электронов: атомы металлов имеют особенность, называемую "море свободных электронов". Это означает, что электроны, не привязанные к отдельным атомам, свободно перемещаются по кристаллической структуре, что позволяет металлам хорошо проводить электричество и тепло.
Все эти характеристики делают атомы металлов основными строительными блоками в их кристаллической структуре и определяют их основные физические и химические свойства.
Кристаллическая структура металлов: особенности и свойства
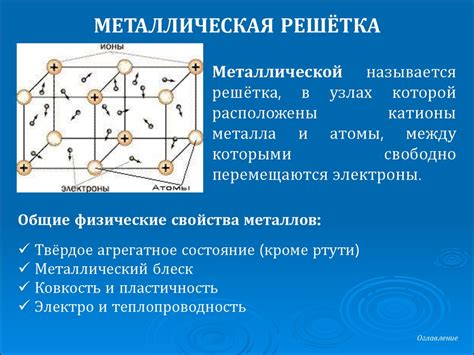
Кристаллическая структура является одной из ключевых особенностей металлов и определяет их свойства. Основные компоненты кристаллической структуры металлов это атомы и кристаллическая решетка.
Атомы металлов имеют своеобразные свойства, такие как подвижность и высокая проводимость электричества и тепла. Они обладают свободными электронами в валентной зоне, что позволяет им легко перемещаться по металлической решетке.
Кристаллическая решетка металлов образована атомами, которые располагаются в определенном порядке и образуют пространственную решетку. Кристаллическая структура может быть различной: центрированная кубическая, гексагональная, тетрагональная и т. д. В каждом таком типе структуры атомы металлов располагаются по определенной схеме, образуя устойчивую и прочную решетку.
Одним из главных свойств металлов, связанных с их кристаллической структурой, является металлическая связь. Она образуется за счет взаимодействия свободных электронов в валентной зоне атомов и создает прочные связи между атомами, что обуславливает высокие физические свойства металлов, такие как прочность, твердость и пластичность.
Знание особенностей атомов и кристаллической структуры металлов позволяет контролировать их свойства и использовать в различных областях, включая производство металлических изделий, электронику и строительство. Таким образом, изучение кристаллической структуры металлов является важным элементом в науке и технологии металлов.
Металлическая связь: влияние на структуру атомов

Металлическая связь – это особый тип химической связи, характерный для металлов. Центральным элементом металлической связи является положительно заряженное ядро атома металла, окруженное «облаком» свободных электронов. Влияние металлической связи на структуру атомов металлов является одним из главных факторов, определяющих их физические и химические свойства.
Металлическая связь обладает особым свойством – высокой подвижностью электронов внутри металлической структуры. Это объясняется тем, что электроны, находящиеся в облаке, не принадлежат конкретному атому, а свободно перемещаются по всей структуре. Такая подвижность электронов позволяет атомам металла образовывать кристаллическую решетку, обладающую определенными свойствами, в том числе высокой проводимостью электричества и тепла.
Влияние металлической связи на структуру атомов металлов проявляется в том, что атомы металла располагаются в кристаллической решетке регулярно, образуя кристаллические пакеты. Это обусловлено тем, что каждый атом металла имеет несколько электронов, которые образуют свободное электронное облако. Такое упорядоченное расположение атомов в структуре металла обеспечивает его цельность и прочность.
Металлическая связь также влияет на механические свойства атомов металлов. Благодаря свободным электронам в облаке, металлы обладают высокой пластичностью и деформируемостью. Это позволяет атомам металла двигаться относительно друг друга без разрушения металлической структуры. Кроме того, металлическая связь обеспечивает атомам металлов высокую электропроводность и теплопроводность.
Металлические элементы: различия в кристаллической структуре
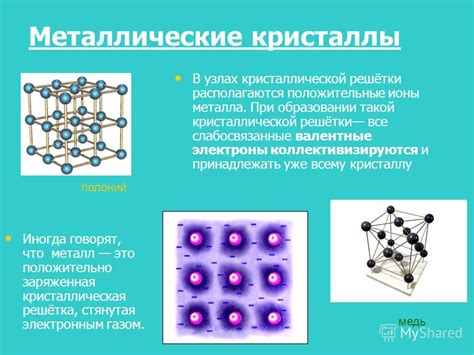
Металлы - это класс веществ, обладающих рядом характерных свойств, включая высокую электропроводность и термическую проводимость. Одной из основных причин этих свойств является особенность кристаллической структуры металлов.
В металлической структуре атомы основного элемента образуют кристаллическую решетку, в которой они расположены в регулярном порядке. В отличие от атомов в кристаллических структурах неметаллических веществ, атомы металлов обладают высокой подвижностью и могут перемещаться внутри своих позиций в решетке. Такая подвижность атомов обуславливает возможность пластической деформации металлов и их способность к термообработке.
Кристаллическая структура металлов может быть различной и зависит от их химического состава и факторов внешней среды. Некоторые металлы имеют простую кристаллическую структуру, например, кубическую или гексагональную, в то время как другие образуют более сложные решетки.
Причина различий в кристаллической структуре металлов заключается в их электронной конфигурации и способности образовывать связи между атомами. Интератомные связи в металле обладают координационным характером, что позволяет атомам формировать устойчивые кристаллические решетки.
В целом, кристаллическая структура металлов играет ключевую роль в определении их свойств и поведения при различных условиях. Изучение и понимание этих особенностей позволяет разрабатывать новые сплавы и материалы с улучшенными характеристиками и применением в различных областях промышленности.
Фазовые переходы в металлах: возможности атомов при изменении структуры
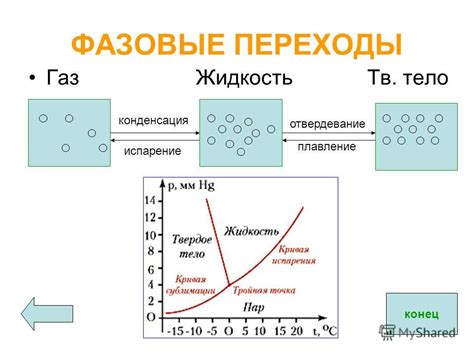
Металлы обладают уникальной способностью претерпевать фазовые переходы, в результате которых изменяется их кристаллическая структура. Эти переходы могут быть вызваны различными факторами, такими как изменение температуры, давления или добавление примесей.
В процессе фазовых переходов атомы металла приобретают новые возможности. Например, при повышении температуры атомы металла начинают двигаться быстрее и имеют большую свободу перемещения. Это приводит к изменению структуры металла, в результате чего его механические свойства могут меняться.
Другим примером фазового перехода является переход от одной кристаллической решетки к другой. При изменении температуры или других условий, атомы могут переходить из одной решетки в другую, что приводит к изменению физических свойств металла, таких как проводимость электричества или теплоемкость.
Кроме того, добавление примесей в металл также может вызывать фазовый переход. Примеси могут встраиваться в кристаллическую структуру металла, вызывая изменение его свойств. Например, добавление некоторых примесей может повысить твердость или улучшить коррозионную стойкость металла.
Вопрос-ответ

Какие основные факты о кристаллической структуре металлов стоит знать?
Кристаллическая структура металлов характеризуется регулярным расположением атомов в кристаллической решетке. Основные факты о кристаллической структуре металлов включают: наличие металлической связи между атомами, деформационные механизмы при воздействии механических напряжений и электрическом поле, а также возможность образования дефектов, таких как точечные дефекты (включения, вакансии), дислокации и границы зерен.
Как связаны атомы в металлах в кристаллической структуре?
Атомы в металлах связаны металлической связью, которая характеризуется перемещением электронов между атомами. Это обеспечивает высокую проводимость электричества и тепла в металлах. Металлическая связь также отвечает за химическую и физическую устойчивость металлов, а также их механические свойства, такие как прочность и пластичность.
