Периоды в периодической системе химических элементов являются горизонтальными рядами элементов, расположенными по возрастанию атомного номера. Всего в таблице Менделеева существует семь периодов, и каждый из них имеет свои особенности. Возникает вопрос: находятся ли все щелочные металлы в одном периоде?
Щелочные металлы - это группа элементов, которые находятся в первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы являются очень активными и реактивными элементами, которые имеют свойства, связанные с низкой электроотрицательностью и высокой реактивностью.
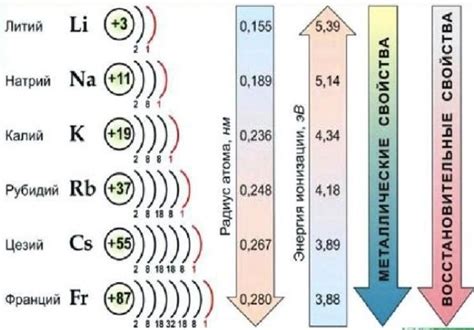
Ответ на вопрос о том, принадлежат ли все щелочные металлы одному периоду, отрицателен. Фактически, они расположены не в одном, а в разных периодах. Литий (Li) и натрий (Na) находятся во втором периоде, калий (K), рубидий (Rb) и цезий (Cs) - в третьем периоде, а франций (Fr) - в седьмом периоде. Таким образом, каждый из щелочных металлов занимает свое место в таблице Менделеева, определенное его атомным номером и химическими свойствами.
Щелочные металлы и их периодичность
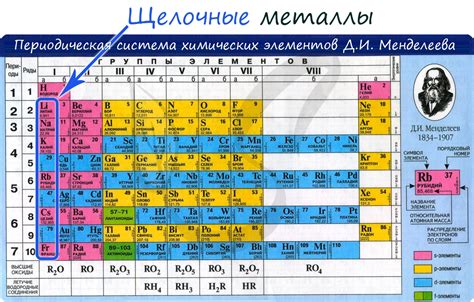
Щелочные металлы - это элементы, относящиеся к первой группе периодической системы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они все относятся к одному периоду - второму периоду периодической системы.
Периодичность щелочных металлов включает в себя увеличение атомных радиусов, ионных радиусов и массы атома при движении по группе от лития к францию. Кроме того, увеличивается остаточный заряд ядра, а также металлические и химические свойства.
Наиболее известными свойствами щелочных металлов являются их высокие активность и реактивность. Они легко реагируют с водой, кислородом и другими неорганическими соединениями. Кроме того, они обладают низкой плотностью, низкой температурой плавления и высокой проводимостью электричества и тепла.
Щелочные металлы имеют широкое применение в различных областях науки и техники. Они используются в производстве щелочных элементов, лития-ионных аккумуляторов, сплавов и других материалов. Кроме того, они играют важную роль в биологических процессах и в медицине.
Таким образом, все щелочные металлы относятся к одному периоду периодической системы. Они обладают сходными химическими и физическими свойствами, но имеют свои особенности и применяются в различных областях науки и промышленности.
Чем отличаются щелочные металлы?
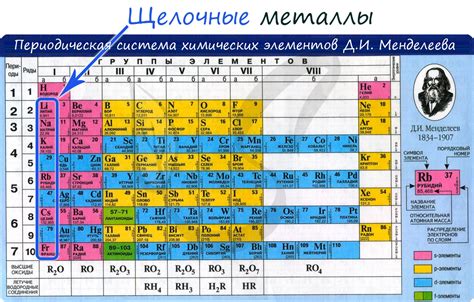
Щелочные металлы представляют собой группу химических элементов, которые относятся к первой группе периодической системы Менделеева. Эта группа включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Хотя все щелочные металлы при взаимодействии с водой образуют щелочи, они имеют ряд отличительных особенностей.
Во-первых, щелочные металлы являются очень реактивными и хорошими противоядиями. Они имеют низкую энергию ионизации и легко отдают свой внешний электрон, образуя одновалентные положительные ионы. Это делает их хорошими агентами окисления и причиняет им низкую степень растворимости в воде.
Во-вторых, каждый щелочный металл имеет свои уникальные химические и физические свойства. Например, литий является наименьшим и наиболее твердым из всех щелочных металлов, а франций является самым редким и самым нестабильным. Кроме того, различные щелочные металлы имеют различные плотности, точки плавления и кипения.
В-третьих, щелочные металлы формируют множество соединений с другими элементами, обладающих различными свойствами. Некоторые из них образуют сплавы с другими металлами, такими как алюминий и магний, что делает их полезными в промышленности. Кроме того, щелочные металлы широко используются в производстве батарей, стекла, мыла и других продуктов.
В заключение, хотя все щелочные металлы относятся к одной группе периодической системы, они обладают уникальными свойствами, которые отличают их друг от друга. Это делает их важными элементами в химической и промышленной промышленности, а также объектами многих научных исследований.
Периодичность расположения в таблице Менделеева
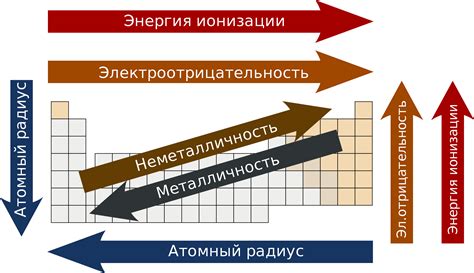
Таблица Менделеева - это систематическое упорядочение химических элементов по их атомным номерам, электронной конфигурации и химическим свойствам. В таблице Менделеева элементы располагаются в порядке возрастания атомных номеров и группируются в периоды и группы.
Периоды - это горизонтальные ряды элементов в таблице Менделеева. Всего в таблице Менделеева семь периодов. Каждый новый период начинается с элемента, у которого добавляется новый энергетический уровень.
Внутри периодов элементы располагаются в порядке возрастания атомных номеров, что является одной из основных характеристик периодического закона. В каждом периоде каждый элемент имеет одно энергетическое уровень, на котором находится его валентная оболочка.
Группы - это вертикальные столбцы элементов в таблице Менделеева. Всего в таблице Менделеева 18 групп. Элементы внутри каждой группы имеют одинаковые химические свойства, так как они имеют одинаковое количество электронов во внешней электронной оболочке.
Однако не все элементы в одной группе имеют одинаковое количество электронов. Например, группа щелочных металлов содержит элементы с одним электроном на внешней оболочке - литий, натрий, калий и т.д. Но при этом они не относятся к одному периоду, так как у них разное количество энергетических уровней. Таким образом, таблица Менделеева отражает периодичность расположения элементов в зависимости от количества энергетических уровней и химических свойств.
Сходства и различия периодов щелочных металлов
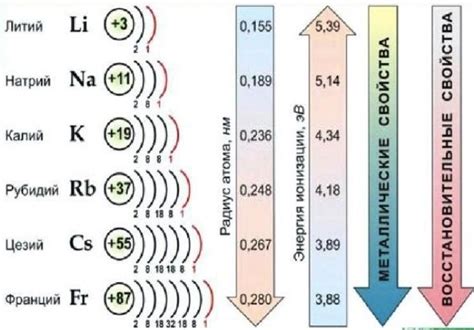
Периодическая система элементов представляет щелочные металлы в первой группе, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Несмотря на то, что все они относятся к одному периоду, они имеют существенные сходства и различия.
Сходства:
- Все щелочные металлы имеют один валентный электрон во внешней электронной оболочке, что делает их очень реактивными.
- Они являются очень реактивными металлами и легко окисляются воздухом или реагируют с водой.
- Все щелочные металлы имеют низкую плотность и низкую температуру плавления.
- Они хорошо проводят тепло и электричество.
Различия:
- Периодически увеличивается размер и атомная масса щелочных металлов.
- Некоторые щелочные металлы, такие как литий и натрий, обладают более низкой плотностью и меньшей реактивностью по сравнению с другими металлами этой группы.
- Точки плавления и кипения щелочных металлов также увеличиваются по мере движения по периоду.
- У редких щелочных металлов, таких как рубидий, цезий и франций, имеются более высокие значения плотности и более высокая реактивность.
Однако, несмотря на различия в их физических свойствах, щелочные металлы обладают общими химическими свойствами, такими как способность образования ионов с положительным зарядом и образование оснований.
Атрибуты щелочных металлов в технологии
Щелочные металлы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают рядом уникальных атрибутов, которые находят применение в различных технологических процессах.
Во-первых, щелочные металлы отличаются высокой электропроводностью, что делает их необходимыми в производстве конденсаторов, электродов, батарей и прочих устройств, где требуется эффективное проведение электричества.
Во-вторых, щелочные металлы обладают способностью легко реагировать с кислородом воздуха и водой, что позволяет использовать их в процессе очистки и обеззараживания воды. Кроме того, щелочные металлы широко применяются в сельском хозяйстве для улучшения почв и повышения урожайности.
В-третьих, щелочные металлы используются в процессе производства стекла. Они способны увеличивать прозрачность стекла и улучшать его естественные свойства, такие как теплопроводность и химическая стабильность. Кроме того, щелочные металлы придают стеклу особую цветовую гамму, используемую в производстве различных изделий, от окон до посуды.
Неотъемлемой частью многих технологических процессов является использование щелочных металлов, которые благодаря своим особенностям находят применение в различных отраслях промышленности и науки.
Вопрос-ответ

Все щелочные металлы относятся к одному периоду?
Нет, не все щелочные металлы относятся к одному периоду. В периоде находятся элементы, имеющие одинаковое количество энергетических уровней, и щелочные металлы находятся в двух различных периодах - натрий, калий и рубидий в 3-м периоде, а цезий и франций в 6-м периоде.
Какие щелочные металлы относятся к одному периоду?
Все щелочные металлы не относятся к одному периоду. Натрий, калий и рубидий расположены в 3-м периоде, а цезий и франций - в 6-м периоде.
Почему щелочные металлы не относятся к одному периоду?
Щелочные металлы не относятся к одному периоду, потому что они имеют различное количество энергетических уровней. Натрий, калий и рубидий имеют 3 энергетических уровня, а цезий и франций имеют 6 энергетических уровней, поэтому они расположены в разных периодах.
Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся элементы первой группы периодической таблицы: литий, натрий, калий, рубидий, цезий и франций. Они обладают высокой реактивностью и активно взаимодействуют с водой.
Какова химическая активность щелочных металлов?
Щелочные металлы обладают очень высокой химической активностью. Они легко окисляются и реагируют с водой, выделяя воспламеняющийся водород. Также они образуют ионы положительного заряда, что делает их отличными катионами.
