Металлы - это особая группа химических элементов, которые обладают рядом характерных особенностей. Они являются одним из основных строительных материалов нашего мира и находят широкое применение в различных отраслях промышленности.
Одной из основных химических особенностей металлов является их способность образовывать ионные соединения. Металлы отдают электроны, образуя положительно заряженные ионы, которые могут соединяться с атомами других элементов, образуя стабильные химические соединения.
Другой важной особенностью металлов является их хорошая электропроводность. В этом заключается одно из применений металлов в электротехнике и электронике. Благодаря своей способности проводить электрический ток, металлы могут использоваться для создания проводников и контактов в различных устройствах.
Кроме того, металлы обладают высоким теплопроводом, что делает их незаменимыми материалами для создания теплообменных поверхностей и теплоносителей в технике. Они также обладают высокой пластичностью и прочностью, что делает их идеальными для создания конструкций и деталей, которые должны выдерживать большие нагрузки.
Общие свойства металлов

Металлы - это группа химических элементов, обладающих рядом общих свойств, которые делают их отличными от других веществ. Одной из основных характеристик металлов является их хорошая проводимость электричества и тепла. Это связано с особенностями внутренней структуры металлической решетки, которая обеспечивает высокую подвижность свободных электронов.
Еще одной характерной чертой металлов является их блеск или металлический блеск. Это связано с отражением света от поверхности металла, что делает его ярким и приятным на внешний вид. Кроме того, металлы обычно обладают высокой плотностью, твердостью и пластичностью, что позволяет им быть легко обрабатываемыми и формоваться в различные изделия и конструкции.
Также металлы обладают высокой температурой плавления, что делает их идеальными материалами для использования в высокотемпературных процессах, таких как плавка и литье металлических изделий. Они также хорошо растворимы в других металлах, что позволяет создавать сплавы с различными свойствами.
В целом, свойства металлов делают их важными материалами в различных отраслях промышленности, включая машиностроение, электронику, строительство и многое другое. Изучение и понимание общих свойств металлов позволяют нам лучше использовать их потенциал и создавать новые материалы с улучшенными характеристиками.
Атомная структура металлов
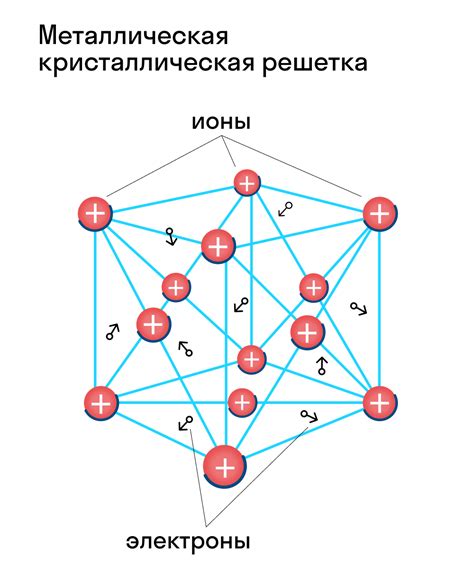
Металлы отличаются особой атомной структурой, которая обуславливает их химические и физические свойства. В атоме металла электроны расположены в нескольких энергетических уровнях. Основной вклад в химическую активность металла вносят его внешние электроны – электроны на самом последнем энергетическом уровне, называемом валентным энергетическим уровнем.
В то время как атомы неметаллов обычно стремятся заполнить свои внешние энергетические уровни путем присоединения электронов от других атомов, атомы металлов обладают особой способностью отдавать один или несколько валентных электронов, образуя положительно заряженные ионы. Это делает металлы хорошими переносчиками электрического тока и тепла.
В металлах атомы образуют кристаллическую решетку. Каждый атом металла соединяется с соседними атомами, образуя металлические связи. Эти связи обеспечивают прочность и деформируемость металлов, позволяя им легко изменять форму без поломки.
Внутри металлического кристалла электроны могут свободно двигаться, образуя так называемый «электронный газ». Это обуславливает электропроводность металлов и их способность сильно поглощать свет, обеспечивая блеск и характерный металлический глянец.
Периодическая таблица и химические свойства металлов
Периодическая таблица химических элементов является важным инструментом в изучении и понимании химических свойств металлов. В ней металлы расположены слева от полупроводников и неметаллов. Они представлены большим количеством элементов, которые обладают определенными общими свойствами.
Химические свойства металлов включают их реактивность, способность образовывать ионы, участие в реакциях окисления и восстановления, а также способность образовывать сплавы с другими металлами. Металлы часто обладают высокой теплопроводностью и электропроводностью, что делает их полезными материалами для различных промышленных и технических приложений.
Некоторые металлы, такие как железо, медь, алюминий и золото, широко используются в производстве различных изделий и конструкций благодаря их прочности, долговечности и сопротивлению коррозии. Кроме того, металлы также часто используются в электронике, автомобильной промышленности, строительстве и других отраслях.
Металлы могут образовывать разнообразные соединения, включая оксиды, сульфиды, хлориды и другие. Оксиды металлов являются одними из наиболее распространенных и важных соединений. Они могут иметь разные степени окисления и играть роль оксидантов или восстановителей в различных реакциях.
Изучение периодической таблицы и химических свойств металлов позволяет получить более глубокое понимание их уникальных химических и физических свойств. Это помогает ученым и инженерам разрабатывать новые материалы и технологии, улучшать существующие процессы и создавать инновационные продукты для удовлетворения потребностей современного общества.
Реакции металлов с кислотами

Металлы обладают способностью вступать в реакцию с кислотами, что является одним из основных химических свойств металлов. Эти реакции являются экзотермическими и сопровождаются выделением газов и тепла.
Металлы могут взаимодействовать с различными видами кислот, включая сильные и слабые. В результате реакции образуется соль и выделяется водородный газ. В зависимости от активности металла и кислоты, реакция может протекать с разной степенью интенсивности.
Например, активные металлы, как натрий и калий, реагируют с водой, образуя соответствующие гидроксиды и выделяя большое количество водорода. Реакция же металлов более низкой активности, таких как железо или алюминий, с действующими кислотами, например, соляной или серной, протекает медленнее и менее интенсивно.
Также существуют металлы, которые не реагируют с кислотами вообще. Например, золото и платина химически инертны и не подвержены коррозии при контакте с кислотами. Эти металлы широко применяются в ювелирном и промышленном производстве.
Взаимодействие металлов с водой

Металлы могут проявлять различные реакции при контакте с водой. Некоторые из них реагируют с водой незначительно или вообще не вступают в реакцию, в то время как другие металлы реагируют с водой очень активно.
Существует два основных типа реакций металлов с водой. В первом случае, металл образует оксид гидрогена и выделяется водород. Например, натрий реагирует с водой, образуя оксид натрия и выделяя водородный газ:
2Na + 2H2O → 2NaOH + H2
Некоторые металлы, такие как литий и калий, реагируют с водой с такой силой, что выделяющийся водород может воспламениться.
Второй тип реакции характерен для металлов более высокой активности, таких как магний или алюминий. В этом случае металл реагирует с водой, образуя гидроксид металла и выделяя водород:
2Al + 6H2O → 2Al(OH)3 + 3H2
Некоторые металлы, такие как железо и цинк, реагируют с водой только при наличии кислорода. В этом случае металл окисляется до соответствующего гидроксида, а вода превращается в молекулярный кислород:
4Fe + 3O2 + 6H2O → 4Fe(OH)3
Таким образом, взаимодействие металлов с водой может быть различным в зависимости от их активности и окружающих условий. Эти реакции имеют значительное практическое применение в различных сферах, таких как промышленное производство и технологии очистки воды.
Химические свойства металлов в соединениях

Металлы обладают разнообразными химическими свойствами при взаимодействии с другими веществами. Одной из наиболее характерных особенностей металлов является их способность образовывать соединения с различными не-металлами. Эти соединения обладают своими уникальными свойствами и широко применяются в различных областях науки и техники.
Металлы могут образовывать соединения с большим количеством не-металлов, например, с кислородом, серой, азотом, хлором и т.д. Как правило, металлы обладают электроотрицательностью ниже, чем эти не-металлы, поэтому при взаимодействии они образуют ионные соединения. В таких соединениях металл передает свои электроны не-металлу, образуя положительно заряженный ион, а не-металл получает электроны и образует отрицательно заряженный ион.
Соединения металлов с кислородом называются оксидами. Они могут иметь различную степень окисления металла и могут быть как кислыми, так и основными. Некоторые известные оксиды металлов включают оксид железа, алюминия и меди. Оксиды металлов часто используются в качестве катализаторов, пигментов и в производстве стекла.
Металлы также могут образовывать соли с кислотами. Эти соединения называются металлическими солями. Соли металлов часто используются в качестве добавок в пищевую промышленность, в медицине и в производстве удобрений.
Важным классом соединений металлов являются гидриды, в которых металл соединен с водородом. Гидриды металлов обладают различными свойствами и широко применяются в химической промышленности, например, в процессах полимеризации и каталитической конверсии.
Таким образом, химические свойства металлов в соединениях представляют огромную область исследований, которая имеет множество практических применений. Знание и понимание этих свойств позволяет разрабатывать новые материалы и технологии, а также использовать металлы и их соединения в различных областях жизни человека.
Коррозия и окисление металлов

Коррозия – это процесс окисления металлической поверхности при взаимодействии с окружающей средой. Она является нежелательным явлением, так как приводит к разрушению и деформации металла. В основном коррозия возникает под влиянием влаги и воздуха. Поверхность металла сначала покрывается оксидной пленкой, которая затем продолжает расти. В результате происходит разрушение металла и образование ржавчины.
Оксидация – это процесс взаимодействия металла с кислородом. При окислении металла происходит переход электронов между атомами металла и молекулами кислорода. Окисление приводит к образованию оксидов, которые могут иметь различные свойства. К примеру, черная оксидная пленка на поверхности железа называется "магнитной ржавчиной", а зеленоватая пленка на меди называется "вердигрис".
Для защиты от коррозии и окисления металлов применяются различные методы. Одним из них является напыление защитных покрытий на поверхность металла. Такие покрытия предотвращают попадание влаги и кислорода на металл и способствуют его сохранению. Кроме того, для защиты металлов используют антикоррозийные препараты, которые образуют на поверхности защитную пленку.
Коррозия и окисление металлов – важные явления, с которыми сталкиваются в повседневной жизни. Понимание причин этих процессов и разработка методов их предотвращения позволяют сохранить металлические изделия в отличном состоянии и продлить их срок службы.
Вопрос-ответ

Какие основные свойства металлов?
Металлы обладают множеством уникальных свойств, таких как высокая теплопроводность, электропроводность, пластичность, хорошая термическая и химическая стойкость, а также возможность образования сплавов.
Что такое окисление металлов?
Окисление металлов - это процесс, при котором металл взаимодействует с кислородом из воздуха или другими окислителями, что приводит к образованию оксида металла. Это может происходить под воздействием высокой температуры, влаги, кислот или других химических веществ.
Что такое пассивация металлов и какова ее роль?
Пассивация металлов - это процесс, при котором поверхность металла покрывается защитным слоем оксида или других веществ, что препятствует дальнейшему окислению или коррозии. Это слой обладает хорошей адгезией и обеспечивает долговечность металлической поверхности.
Какие факторы влияют на химическую реакцию металлов?
Химическая реакция металлов зависит от таких факторов, как тип металла, его поверхностная обработка, наличие оксидов или других загрязнений на поверхности, температура, влажность окружающей среды, pH среды, а также наличие других химических реагентов.
