Оксиды – это химические соединения, состоящие из кислорода и других элементов. Эти соединения широко распространены в природе и играют важную роль в различных процессах. Существуют различные типы оксидов, включая основные оксиды, кислотные оксиды и нейтральные оксиды. В данной статье мы рассмотрим основные оксиды и их свойства.
Основные оксиды – это соединения, в которых кислород связан с металлом. В результате образуется щелочное или щелочноземельное вещество. Эти оксиды обычно проявляют щелочные свойства, то есть они способны реагировать с кислотами и образовывать соли. Они обычно обладают основными свойствами, такими как щелочной вкус и способность растворяться в воде.
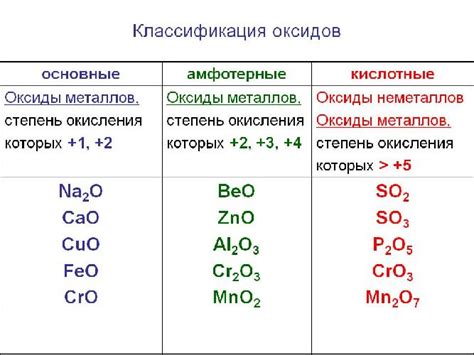
Примерами основных оксидов являются оксид натрия (Na2O), оксид калия (K2O) и оксид кальция (CaO). Оксид натрия образует гидроксид натрия при реакции с водой, что делает его основным веществом. Оксид калия также реагирует с водой, образуя гидроксид калия. Оксид кальция используется в производстве цемента и имеет щелочные свойства.
Важно знать: Основные оксиды играют важную роль во многих областях, включая промышленность, сельское хозяйство и медицину. Они используются в производстве стекла и керамики, а также в качестве удобрений и лекарств. Основные оксиды также играют ключевую роль в окислительно-восстановительных реакциях и электролизе.
В заключение можно сказать, что основные оксиды – это соединения кислорода с металлами, обладающие щелочными свойствами. Они широко используются в различных отраслях и имеют важное значение для нашей повседневной жизни.
Основные оксиды
Основные оксиды – это соединения, которые образуются при соединении кислорода с металлами. Они обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы.
Основные оксиды можно классифицировать на основании их химической формулы и свойств. Некоторые из них являются амфотерными, что означает, что они могут реагировать как щелочи, так и кислоты. Это свойство позволяет им реагировать с различными веществами и участвовать в разнообразных химических реакциях.
Примерами основных оксидов являются оксид калия (К2O), оксид натрия (Na2O), оксид магния (MgO) и оксид алюминия (Al2O3). Каждый из них обладает уникальными свойствами и находит свое применение в различных отраслях промышленности и научных исследованиях.
Свойства основных оксидов

Основные оксиды — это химические соединения, которые образуются при соединении металлов с кислородом. Они обладают рядом характерных свойств, которые делают их уникальными и важными для различных процессов и применений.
Растворимость: большинство основных оксидов растворяется в воде, образуя гидроксиды металлов. Это свойство позволяет использовать основные оксиды для получения растворов различной концентрации и использования в различных отраслях промышленности.
Базические свойства: основные оксиды обладают выраженными базическими свойствами, что проявляется в их реакции с водой, где они образуют гидроксиды металлов и восстанавливают кислород. Это свойство делает их важными компонентами проточных и электролитических процессов.
Высокая плотность: многие основные оксиды имеют высокую плотность, что делает их тяжелыми и прочными материалами. Это позволяет использовать их в производстве различных конструкций и материалов, обладающих высокой прочностью и стойкостью к внешним воздействиям.
Реактивность: основные оксиды обладают высокой химической реактивностью, что проявляется в их способности реагировать с другими веществами и изменяться в результате химических превращений. Это свойство делает их важными реагентами в различных химических процессах и синтезе органических соединений.
Термическая стабильность: многие основные оксиды обладают высокой термической стабильностью, что позволяет использовать их при высоких температурах, например, в процессах плавления и спекания металлов и керамики. Это свойство делает их важными материалами для различных промышленных процессов и производства изделий с высокой термостойкостью.
Таким образом, свойства основных оксидов делают их неотъемлемой частью химической и промышленной отраслей, а также предоставляют широкий спектр возможностей для их использования в различных процессах и приложениях.
Примеры основных оксидов

1. Оксид натрия (Na2O)
Оксид натрия является одним из наиболее распространенных основных оксидов. Он образуется при сжигании натрия в кислороде. Оксид натрия обладает щелочными свойствами и широко применяется в производстве стекла, мыла, моющих средств и других химических продуктов.
2. Оксид кальция (CaO)
Оксид кальция, или известь, является еще одним примером основного оксида. Он образуется при нагревании известняка и широко применяется в строительстве, для производства гипсовых изделий, а также в сельском хозяйстве для улучшения почвы.
3. Оксид магния (MgO)
Оксид магния образуется при обжиге магнезита или магниевого гидроксида. Он характеризуется высокой термостойкостью и используется в производстве огнеупорных материалов, а также в медицине как противокислотное средство.
4. Оксид железа (Fe2O3)
Оксид железа, или ржавчина, также является основным оксидом. Он образуется при окислении железа и характеризуется красным цветом. Оксид железа применяется в производстве красок, косметики, а также в производстве стали.
5. Оксид алюминия (Al2O3)
Оксид алюминия образуется при нагревании глинозема и является основным компонентом глины. Он широко используется в производстве керамики, алюминиевого металла, абразивных материалов и других химических продуктов.
Вопрос-ответ

Каково определение оксидов?
Оксиды - это химические соединения, состоящие из атомов кислорода и других химических элементов, которые обычно обладают свойствами оснований или кислот. Они образуются при соединении кислорода с другими элементами и являются основными составными частями земной коры.
Какие свойства обладают основные оксиды?
Основные оксиды обычно обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы. Они реагируют с кислотами, образуя соли и воду. Они обычно имеют высокую температуру плавления и кипения и образуют кристаллическую структуру.
